

INFORME PRELIMINAR SOBRE CENSO DE PRIMATES NO HUMANOS EN EL SUR ORIENTE PERUANO: IBERIA E IÑAPARI (DEPARTAMENTO DE MADRE DE DIOS), MAYO 15 - JUNIO 14,1978.
(Informe presentado al Proyecto Peruano de Primatología , en Julio 1978.)
Filomeno Encarnación y Napoleón Castro
INTRODUCCIÓN
Este informe es un resumen de los resultados del censo de primates no humanos realizado en la Región Sur Oriente del Perú, en localidades aledañas a Iberia e Iñapari, Departamento de Madre de Dios. Desde el 15 de Mayo al 14 de Junio 1978, se ejecutó censos de poblaciones de primates en las áreas de los Ríos Acre, Iñapari, Yaverija, Noaya, Chilinas (curso superior del Río Nareuda) y Río Tahuamanu y próxima a Puerto Maldonado.
Se constató la presencia de la especie Saguinus labiatus, probablemente S. 1. labiatus, según Hershkovitz (1977), lo que viene a ser un nuevo registro para la fauna primatológica peruana. También se obtuvieron datos de densidad poblacional, comportamiento y otras observaciones sobre ésta y otras especies.
ÁREAS DE ESTUDIO
Las áreas de estudio se encuentran ubicadas en el Departamento de Madre de Dios (Sur Oriente del Perú) entre los Ríos Acre y Madre de Dios, muy próximas a las fronteras con Brasil y Bolivia (Fig. l). Para mejor comprensión, anotamos que se trata de dos zonas amplias.
a. Zona Iñapari e Iberia, limitada por los Ríos Acre y Tahuamanu.
b. Zona cercana a Puerto Maldonado, en el Vivero Forestal de la Sub-Zona
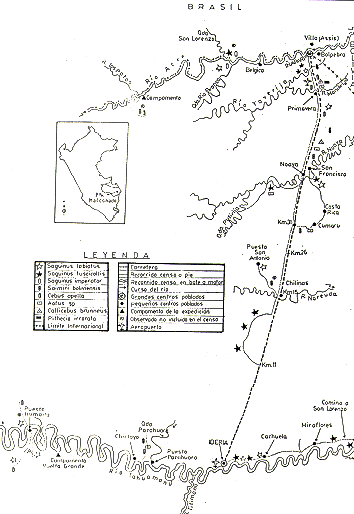
Fig. 1.- Mapa del área de studio,
con la distribución de las observaciones
de presencia para cada especie de primate.
IV, Zona Agraria XI, Puerto Maldonado (capital del Departamento de Madre de Dios).
Ambas áreas se encuentran en la eco-zoorregión
de Selva Baja (Brack 1975,1976) y según el Mapa Ecológico del
Perú (ONERN 1976), pertenecen a la zona de vida del bosque húmedo
Sub-Tropical bh-S/T (Transicional a bosque húmedo tropical).
METODOLOGÍA
Para la ejecución del censo y análisis de datos, se siguió el método descrito por Freese (1975), con muy ligeras variaciones en cuanto a tamaño de manadas y campo auditivo-visual. Se hicieron dos tipos de censo: a pie y en bote motor. En dichos censos participaron generalmente 2 ó 3 personas, una de ellas auxiliar de campo (guía), natural del lugar. En todos los sectores durante el censo a pie se aprovecharon los transectos o "estradas" para la extracción de shiringa (Hevea brasiliensis) y castaña (Bertholletia excelsa). En el último sector del Río Acre se efectuó el censo sin transecto. En ningún caso se consideraron los recorridos por las chacras, potreros y áreas de viviendas. En total, se censaron 104,878 km en bosque; así mismo, se hizo censo a pie en algunos sectores de la carretera carrozable que une Iberia con Iñapari; este camino no es muy frecuentado por vehículos motorizados, lo que facilitó el censo, habiéndose recorrido unos 54,87 km. Los censos en bote motor fueron ejecutados en las cuencas de los Ríos Acre, 78 km y Tahuamanu, 132,5 km, (estos resultados se analizarán posteriormente).
Además, se ejecutaron recorridos y observaciones
complementarias para determinar los campos auditivo-visuales, tamaños
de manadas, comportamiento y otros factores ecológicos del medio. La
visibilidad en el bosque era mejor que en la carretera, donde la presencia de
purmas y pacales (Formación vegetal caracterizada por Guadua sp. Bambuseae-Cramineae)
cerrados disminuyeron la visibilidad. En el caso de Cebus apella asociada con
Saimiri boliviensis, la visibilidad se incrementó por el comportamiento
bullicioso de los últimos. El aspecto cerrado de la carretera no influyó
en la detección de especies como Saimiri boliviensis y Pithecia irrorata
(Cuadro 1).En todos los lugares censados se oyeron voces de Callicebus brunneus
y en sectores distantes de Iberia, Iñapari y Acre se percibieron rugidos
de Alouatta seniculus. Además, la existencia de mascotas de Alouatta
seniculus, Ateles paniscus chamek, Saguinus fuscicollis weddelli y Callicebus
brunneus, con frecuencia proporcionaron datos adicionales sobre abundancia y
distribución de estas especies.
|
Especie |
Bosque |
Campo Auditivo-visual Carretera carrozable |
|
Saguinus labiatus |
60m | 30m |
|
Saguinus fuscicollis |
60m | 30m |
|
Saguinus imperator |
60m | 30m |
|
Saimiri boliviensis |
100m | 100m |
|
Cebus apella |
70m/80m* | 50m/60m* |
|
Aotus sp. |
20m | 10m |
|
Pithecia irrorata |
50m | 50m |
* Asociada con Saimiri boliviensis.
RESULTADOS Y ANÁLISIS
Durante los censos a pie y en bote motor, se realizaron no menos de 50 reconocimientos visuales de manadas de monos, y durante los trabajos de campo sin censar se efectuaron más de 20 observaciones adicionales.
Tamaño de las manadas
El número de manadas encontradas por especie e individuos contados en ellas, fueron como sigue:
Saguinus labiatus. Se observaron 5 manadas integradas por 3, 6, +4,3 y 3 individuos, respectivamente. Sin embargo, las voces de alarma y de larga distancia percibidas indicaron la presencia de más individuos en algunas de ellas. Las manadas con 3 ejemplares corresponden a los sectores de Iñapari e Iberia-Miraflores, donde existe alta presión de caza. El tamaño promedio de manada estimado es de 6 individuos.
Saguinus fuscicollis (S. f. weddelli). De 20 manadas encontradas 18 fueron incluidas en el censo. Se contaron de 1 hasta 8 individuos por encuentro (Cuadro 2); en 11 manadas los conteos fueron incompletos, por lo que se estima como tamaño promedio 6 individuos.
Cuadro 2.- Número de manadas y de individuos
encontrados por especies
| N° Manadas |
Tamaño de Manadas |
Tamaño Promedio | |||
|
C |
NC |
C |
NC |
||
|
Saguinus labiatus |
5 | - | 3,6,+4,3,3 | 6 | |
|
Saguínus fusciollis |
|||||
|
weddelli |
18 | 2 | 5, +2,3,6,+2,+l,+5,+6, | ?,+3 | 6 |
| +2,6,8,+5,3,5,+2,+2 | |||||
| +4,4 | |||||
|
Saguínus ímperator |
2 | 2 | +2,8 | ?,+8 | 8 |
|
Saimiri boliviensis |
4 | 2 | +20,+20, +10, +20 | +30,+27 | 30 |
|
Cebus apella |
9 | 2 | +3,+3,+2,+1,+8,+3,5, | +3,+6 | 8 |
| +4,+6 | |||||
|
Aotus sp. |
4 | - | +1,+1,3,+1 | - | 3 |
|
Callicebus brunneus |
4 | - | +1,3,3,2 | - | 3 |
|
Pithecia irrorata |
1 | - | 3 | - | 5 |
| Total Manadas | 47 | 8 | |||
C : Manadas censadas
NC : Manadas no censadas
+ : Indica que el tamaño fue mayor
? : Indica que fueron observados por el "guía"
Saguinus imperator. Fueron localizadas 4 manadas, 2 en la margen derecha del Río Acre, en una de las cuales se contó 8 ejemplares y en otra 2 a más; las otras 2 manadas se encontraron en territorio brasilero (margen izquierda del Río Acre), integradas por más de 8 individuos. Estos conteos permitieron estimar un tamaño promedio de 8 individuos por manada para esta especie.
Saimiri boliviensis. De 6 manadas vistas 4 son consideradas para el censo. Los conteos generales dieron cifras de 20, 30, 20, 10, 27 y 20, con la posibilidad de mayor número de individuos. Para análisis de datos se consideró como tamaño promedio 30 individuos.
Aotus sp. Se detectó 4 manadas, 2 en el bosque y 2 próximas a carretera. Se contó +l, +l, 3 y +I individuos. Para cálculos de densidad se adoptó el promedio de 3 individuos por manada.
Callicebus brunneus. Cuatro manadas fueron censadas, con 1 a 3 ejemplares. Se estimó como tamaño promedio 3 individuos.
Pithecia irrorata. Fue observada una manada con 3 ó más integrantes. Se asignó un tamaño promedio de 5 individuos.
Densidades poblacionales
Para fines de cómputo de densidades, la zona entre Iberia e Iñapari fue dividida en 8 sectores, según se aprecia en el Cuadro 3. Las densidades obtenidas para cada especie, fueron como sigue:
Saguinus labiatus. Con una densidad total de 0,63 manadas/km2 y 3,78 individuos/km2. Mayor densidad alcanza en los sectores Iberia-Miraflores (1,82 man./km2 y 10,92 ind./kM2) y Yaverija-Primavera (1,48 man./km2 y 8,87 ind./km2), a pesar de la presión de caza en los sectores mencionados.
Saguinus fuscicollis (S. f. weddelli). Alcanza una densidad total de 2,27 man./km2 y 13,6 ind./km2. La densidad se incrementa en los sectores del km 11 al 26 (3,6 man./km2 y 22,8 ind./km2) y de Iberia-Miraflores (3,64 man./km2 y 21,64 ind./kM2). Cerca a Puerto Maldonado, en el Vivero Forestal, km 17 - Carretera a Cuzco, se censó 1,85 km, detectanto un individuo de esta especie.
Saguinus imperator. La densidad total fue de 0,25 man./km2 y 2,02 ind./km2, consiguiendo mayor densidad en el sector Acre (2,87 man./kM2 y 23 ind./km2) hasta desaparecer en lugares cercanos a Iberia.
|
Acre |
Iñapari |
Yaverija Primavera |
Primavera Noaya |
Noaya Km. 26 |
Km. 26 Km. 11 |
Iberia Humaitá |
Iberia Miraflores |
Total | ||
|
B: |
5,81 km | 21,750 km | 9,390 km | 12,600 km | 11,696 km | 12,152 km | 13,170 km | 18,310 km |
104,878 km |
|
|
C: |
- | 4,000 | 3,370 | 18,600 | 16,580 | 11,920 | - | - | 54,870.00 | |
|
T: |
5,81 km | 25,750 km | 13,160 km | 31,200 km | 28,276 km | 24,072 km | 13,170 km | 18,310 km | 159,748 km | |
|
TP |
m/km2 i/km2 | m/km2 i/km2 | m/km2 i/km2 | m/km2 i/km2 | m/km2 i/km2 | m/km2 i/km2 | m/km2 i/km2 | m/km2 i/km2 | ||
| Saginus labiatus | 6 | n.o. | 0.71 4.24 | 1.48 8.87 | n.o. | 0.83 5.00 | n.o. | n.o. | 1.82 10.92 | 0.63 3.78 |
| Saginus fuscicolis | 6 | 2.87 17.21 | 2.12 12.73 | 1.48 8.87 | 0.76 4.57 | 1.67 10.00 | 3.60 22.80 | 2.53 15.19 | 3.64 21.84 | 2.27 13.60 |
| Saginus imperator | 8 | 2.87 22.95 | 0.71 5.66 | n.o. | n.o. | n.o. | n.o. | n.o. | n.o. | 0.25 2.02 |
| Saimiri boliviensis | 30 | n.o. | 0.39 1.65 | 0.76 22.80 | 0.32 9.62 | n.o. | n.o. | 0.76 22.78 | n.o. | 0.25 7.51 |
| Cebus apella | 8 | n.o. | 0.51 4.12 | 1.18 9.46 | 0.55 4.41 | 1.82 14.56 | n.o. | 2.85 22.78 | n.o. | 0.86 6.90 |
| Aoutus sp. | 3 | 8.60 25.82 | n.o. | 4.43 13.30 | 2.28 6.85 | 2.50 7.50 | n.o. | n.o. | n.o. | 1.51 4.53 |
| Callicebus brunneus | 3 | n.o. | n.o. | 2.80 8.40 | 2.67 8.00 | n.o. | n.o. | n.o. | n.o. | 0.94 2.82 |
| Pithecia irroraia | 5 | n.o. | n.o. | 1.52 7.60 | n.o. | n.o. | n.o. | n.o. | n.o. | 0.12 0.62 |
B :Distancia correspondiente al bosque
C :Distancia correspondiente a carretera carrozable
T :Total B+C
m/km2 :Manadas por kilómetro cuadrado
i/km2 :Individuos por kilómetro cuadrado
TP :Tamaño promedio adoptado para el cálculo de densidad
n.o. :No observada pero incluida en el censo
Saimiri boliviensis. Con una densidad total de 0,25 man./km2 y 7,51ind./km2, alcanzando mayores densidades en los sectores Yaverija-Primavera (0,76 man./km2 y 22,8 ind./kM2) e Iberia-Humaitá (0,76 man./km2 y 22.78 ind./km2).
Cebus apella. La densidad total fue de 0,86 man./kM2 y 6,9 ind./km2, presentando incremento en los sectores Iberia-Humaitá (2,8 man./kM2 y 22,8 ind./km2), y Noaya - km 26 (1,82 man./kM2 y 14,57 ind./km2). En sectores de Acre e Iberia-Miraflores, donde la presión de caza es alta, la especie tiende a desaparecer.
Aotus sp.. Alcanza densidad total de 1,51 man./km2 y 4,53 ind./km2. Los sectores de mayor densidad fueron de Acre (8,6 man./km2 y 25,82 ind./kM2) y Yaverija-Primavera (4,43 man./kM2 y 13,3 ind./kM2).
Callicebus brunneus. Se obtuvo densidad total de 0,94 man./km2 y 2,82 ind./km2, correspondiendo a los sectores de Iñapari hasta Primavera la mayor densidad (2,8 man./kM2 y 8,4 ind./km2; y 2,67 man./kM2 y 8,0 ind./km respectivamente). Sin embargo, las voces percibidas nos permiten afirmar que esta especie es abundante.
Pithecia irrorata. La manada observada y el cálculo posterior dieron como densidad total 0,12 man./kM2 y 0,62 ind./km2, perteneciendo 1,52 man./km2 y 7,6 ind./km2 para el sector Yaverija-Primavera.
Observaciones de comportamiento
Saguinus fuscicollis weddelli muestra una tendencia de asociarse con S. labiatus y S. imperator. Esta conducta es similar a la observada en otras subespecies de S. fuscicollis con relación a Saguinus mystax. En 2 casos se les observó en asociación con Callicebus brunneus, comportamiento que puede darse como casual. Sin embargo, cuando ingresa a terrenos agropecuarios, preferentemente plantaciones de plátanos o purmas con remanentes de frutales, lo hace generalmente solo, es decir, fuera de asociación con otras especies.
Al asociarse S. f. weddelli con S. labiatus, se observó que los primeros ocupan el estrato bajo del bosque, hasta aproximadamente 2 a 6 m de alto y siempre manteniéndose a distancia de 10 a 40 m de la manada de S. labiatus. Al advertir presencia humana emiten voces de alarma, ubicándose en posición vertical sobre los troncos y ramas medianas. Los S. labiatus al oír las voces de sus congéneres, tratan de conseguir las ramas altas, mediante saltos muy suaves y sigilosos; en típica acción felina, quedándose inmóviles antes de dar el salto subsiguiente. En 3 ejemplares de S. labiatus observamos una posición de completo relajamiento y flacidez corporal, descansando horizontalmente la porción pectoral y ventral sobre las ramas. Siempre prefieren las ramas casi horizontales de los árboles. Cuando la presencia de los participantes del censo fue repentina, se escucharon las voces de alarma, muy similares a las emitidas por S. mystax al dispersarse la manada. En general, son menos bulliciosos, más sigilosos, cautelosos y rápidos que los S. mystax.
S. imperator muestra un comportamiento muy similar al S. labiatus. Emite voces en tono más grave y corto que S. mystax y huyen tan rápido, sin antes lograr reconocer la presencia humana; sus saltos son más lentos y torpes, y son más bulliciosos. Las tres especies mencionadas son de hábitos preferentemente cazadores de insectos y arañas.
Cebus apella fue observado con frecuencia en asociación con los bulliciosos Saimiri boliviensis, desplazándose juntos en los pacales y palmales. En dos ocasiones se les observó golpeando y rompiendo cañas de paca, probablemente en busca de agua o de insectos. También, golpea frutos de castaña para alimentarse de las nueces y, en una ocasión, los observamos comiendo frutos de shapaja (Scheelea cephalotes).
Callicebus brunneus, se mostraron indiferentes a la presencia y proximidad del observador. En una ocasión, observamos una manada en franco enfrentamiento vocal con otra no avistada.
Pithecia irrorata, es ágil, sigiloso y cauteloso; se le observó en la copa de un árbol de Ficus sp.
Alouatta seniculus, lentos y pasivos, aprovechan la radiación solar matutina sobre las ramas altas de los árboles de copa abierta, tales como Jacaranda sp., Erythrina sp. y Chorisia sp., cuyas flores les sirven de alimento, igualmente los frutos de ojé (Ficus anthelmintica) y renaco (Ficus sp.).
Situación de los primates
Las especies de mayor tamaño (Ateles paniscus y Alouatta seniculus) se pueden encontrar únicamente en las cabeceras de los Ríos Acre y Tahuamanu, muy alejados de los poblados de Iñapari e Iberia, debido a la fuerte presión de caza de subsistencia y como cebo para captura de tigres y tigrillos. Otras especies de tamaño mediano, como el Cebus apella, Pithecia irrorata, Callicebus brunneus y Aotus sp., aún se pueden encontrar muy cerca de los centros poblados. Las especies de Saguinus y Saimiri boliviensis son factibles observarlas en las áreas estudiadas, aunque en algunos lugares como Iberia, por ejemplo, S. labiatus es objeto de caza de subsistencia por algunos campesinos. Estas observaciones nos permiten afirmar que las especies pequeñas se encuentran en situación vulnerable y las más grandes, amenazadas de extinción.
CONCLUSIONES
Saguinus labiatus fue observado por primera vez en nuestro país, con la cual se registran 20 especies de primates para el Perú (Castro 1977).
Durante el período de censo (Mayo 15-Junio 14 de 1978), la densidad de S. labiatus fue relativamente alta en los sectores Iñapari-Yaverija, Yaverija-Primavera, Noaya e Iberia-Miraflores, todos cercanos a la frontera con Bolivia.
S. fuscicollis weddelli y S. imperator también alcanzan densidades poblacionales relativamente altas en los sectores estudiados.
S labiatus y S. imperator habitan de preferencia en los bosques altos no inundables y con escaso sotobosque, aunque S. imperator y S. f. weddelli ocupan también los pacales, purmas y sotobosques.
S. f weddelli generalmente se encuentra asociado con S. labiatus y S. imperator, sirviéndoles a estos últimos como "peones" o "centinelas" (similar a la conducta del S.f. nigrifrons con S. mystax en el Nor Oriente).
Las otras especies de primates encontradas en las áreas de estudio, fueron: Saimiri boliviensis, Cebus apella, Aotus sp., Callicebus brunneus, Pithecia irrorata y Alouatta seniculus. Fueron observadas como mascotas Ateles paniscus chamek, Alouatta seniculus, Callicebus brunneus y S. f. weddelli.
En los sectores del Acre e Iberia se tiene referencia de una alta presión de caza que incide sobre los primates, contraviniendo las vedas vigentes.
RECOMENDACIONES
Después del reconocimiento de las localidades y medio ecológico de las áreas estudiadas, se recomienda lo siguiente:
Ejecutar otra evaluación de S. labiatus y otras especies, durante los meses de Agosto a Octubre, para observar la influencia de las variaciones estacionales en la densidad poblacional. No es recomendable efectuar censos entre Noviembre y Abril, por las altas precipitaciones y maduración (caída) de nueces de castaña (Bertholletia excelsa). Con la experiencia obtenida, no debemos repetir censos entre Mayo y Junio, por la incidencia de los vientos andinos del Sur ("friaje") que bajan la temperatura hasta menos de 10'C en la región, dificultando las operaciones.
Capturar manadas de S. labiatus y S. imperator para verificación de la taxonomía subespecífica, conocer la composición, estudios de comportamiento en cautiverio y otras investigaciones.
Considerando la importancia del manejo y aprovechamiento racional de S. labiatus, se recomienda incentivar, en la región estudiada, campañas de educación sobre conservación de los primates no humanos, debido a que esta especie, a pesar de su mediana envergadura, soporta presión de caza de subsistencia.
REFERENCIAS
Brack, A. 1975. Mapa de las Regiones Eco-Zoogeográficas
del Perú. Lima.
Brack, A. 1976. Ecología Animal. 1: Sinecología. Universidad
Nacional Agraria La Molina, Lima, Perú. 113 pp.Castro, N. 1977.
Lineamientos para la conservación de primates en el Perú. En:
Primera Conferencia Interamericana sobre la Conservación y Utilización
de Primates Americanos No Humanos en las Investigaciones Bíomédicas.
(Lima, Pen3,24 Jun. 1975). OPS, Wash., D.C. Publ. Cient. 317: 228-247.
Freese, C. 1975. Final Report. A census of nonhuman primates in Peru.
PAHO, Wash., D.C. 42 pp.
Hershkovitz, P. 1977. Living New World Monkeys (Platyrrhini). Vol. 1.
University of Chicago Press, Chicago. XIV + 1117 pp. and Figs.
Oficina Nacional de Evaluación de Recursos Naturales (ONERN).
1976. Mapa Eco lógico del Perú y Guía Explicativa. Lima,
Perú.

OBSERVACIONES SOBRE PRIMATES NO HUMANOS EN EL RIO YUVINETO (RIO PUTUMAYO) LORETO, PERU.
(Trabajo realizado con aporte del Proyecto Peruano de Primatología y de la Cooperación Técnica Suiza (COTESU)
Filomeno Encarnación, Napoleón Castro y Patrick
de Rham
INTRODUCCIÓN
En Agosto 1978, se ejecutaron estudios sobre la fauna primatológica área del Río Yuvineto (afluente derecho del Río Putumayo); se registró los tamaños de manadas, dando énfasis al comportamiento de las especies en las áreas de muestreo. Además, el trabajo expone un breve análisis sobre el aprovechamiento y uso racional de los recursos vegetales y animales silvestres por poblaciones humanas nativas de los Grupos Secoya e Ingano.
Las condiciones meteorológicas adversas durante los días de trabajo, limitaron el acopio de datos para los análisis cuantitativos; sin embargo, las informaciones anotadas son suficientes para comprobar una alta densidad poblacional relativa de las diversas especies de primates no humanos y otras es de la fauna silvestre.
DESCRIPCIÓN DE LAS ÁREAS
Los registros fueron ejecutados en los bosques cercanos a los Caseríos San Martín y Yuvineto, incluyendo los campamentos de grupos nativos conocidos como La Bocana (Grupo Ingano) y Bellavista, Escuela Vieja y Mamepó (Grupo Secoya), en el Río Yuvineto (74º15'- 74º20'O y 0lº00'- 01º05'S; Fig. l).
Ubicación Biogeográfica
El área de estudio corresponde a la eco-zoorregión
de Selva Baja (Brack 1975,1976) y a la zona de vida de Bosque muy Húmedo
Premontano Tropical (bmh-PT), (ONERN 1976). El relieve es plano en las áreas
adyacentes a las orillas de los ríos, determinando "tahuampales",
seguidos de colinas onduladas, con buen drenaje y cortadas por numerosas quebradas
que convergen en pequeñas planicies y ríos, determinando los "aguajales".
El suelo es areno arcilloso, particularmente en las colinas. Las masas de agua,
resultado del drenaje acumulado en pantanos y arrastradas hacia los ríos,
corresponden al tipo de aguas negras, tendiendo a aguas claras (Sioli 1974).
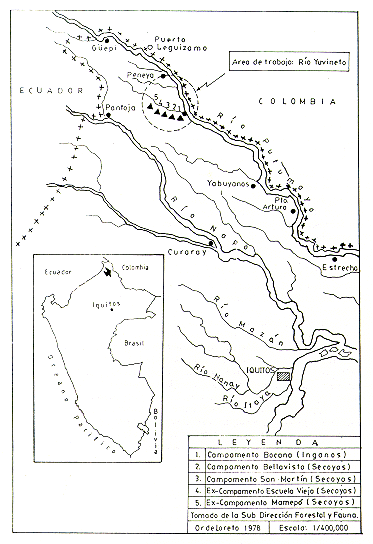
Fig. 1.- Censo de primates no humanos
en áreas del Río Yuvineto (R. Putumayo), Loreto
Vegetación
Básicamente, se diferencian tres tipos de vegetación: dos sujetos a inundación (Prance 1978) y uno asentado en las colinas (formación vegetal BC-11 de Malleux 1975).
Vegetación ribereña e inundable ("Seasonal Várzea" de Prance 1978). Incluye los llamados "tahuampales", con estrato bajo y numerosos bejucos y lianas, principalmente Vitáceas, Malpighiáceas, Leguminosas, Dilleniáceas etc., que alcanzan y cubren la copa de los árboles medianos. Estos últimos están representados por Lecitidáceas de mediana altura, Bombacáceas (Pachira aquatica, Ceiba sp., Bombax sp., etc.), Leguminosas (Inga sp., Pithecellobium spp., etc.), Rubiáceas y Palmas (Astrocaryum sp., Euterpe sp., etc.).
Aguajales ("Swamp forest" de Prance 1978). Las palmeras de aguaje (Mauritia flexuosa y Mauritia sp.) ocupan grandes extensiones entre las planicies intercolinas o "bajiales", formando un bosque completamente pantanoso.
Vegetación de colina o altura (Bosque de Colina Clase 11 de Malleux 1975 y "High Forest" de Prance 1978a). Los árboles alcanzan de 30 hasta 45 m de alto, con los fustes que fluctúan de 30 a 140 cm de diámetro. Son dispersos, con numerosas especies erguidas y delgadas (de tipo "varillal", según Revilla 1974) por la alta luminosidad en el estrato bajo del bosque. Entre los árboles destacan Parkia oppositifolia, P. igneiflora, Cedrela odorata, Cedrela sp, Hevea spp., Ficus spp., Castilloa ulei, Couma macrocarpa, Duroia spp., Pourouma spp., Cecropia spp., etc.; entre las palmeras se hallan Scheelea cephalotes, Jessenia polycarpa, Astrocaryum tucuma, Iriartea exorrhiza, I. ventricosa, Euterpe precatoria, Lepidocaryum tessmannii, Geonoma spp; además, en las pendientes se encuentran helechos arbóreos (Cyathea sp., Dicksonia sp., etc.).
En los tres tipos de vegetación abundan los epífitos de los bosques muy húmedos, diferenciándose los musgos, helechos, aráceas, orquídeas, cuyos portes son entre pequeños y diminutos. También hemiepífitos y estranguladores.
En rápida y somera apreciación de recorrido aéreo desde Iquitos, sobre las localidades de Puerto Arturo, Yuvineto, Peneya, Güepí, Pantoja y Curaray (comprendidas entre los Ríos Napo y Putumayo), se notan amplios bosques de colina con árboles altos y dispersos, atravesados por ríos de aguas negras procedentes de extensos "aguajales", cuyos cursos desembocan en los Ríos Putumayo, Aguarico y Napo. Estos tienen sus nacientes en la región andina oriental de Ecuador y Sur Occidental de Colombia. También destacan las numerosas "cochas" ("ox-bow-lakes") en forma de herradura, medialuna, o sinuosas, determinadas por los meandros o cambios sucesivos de curso en la dinámica estacional de los ríos.
RESULTADOS
Relaciones de la flora y fauna con las poblaciones humanas nativas asentadas.
El bosque (en concepto amplio - Longman y Jenik 19745) cumple rol sinérgico reflexivo o acción de autocontrol con las poblaciones de Secoyas e Inganos; de modo que la caza (incluyendo la pesca) y la tala, son racionadas y selectivas, implicando una actividad rotativa por el comportamiento errante de las poblaciones humanas nativas (Gashe, com. Pers*) (*) jefe del Estudio en ejecución "Influencia de la agricultura errante en el bosque húmedo tropical", por la Misión Científica Franco-Suizo-Peruana, con sede en Bellavista, Río Yuvineto).
Flora Silvestre
La extracción forestal de maderas es mínima y selectiva para el uso en construcciones de viviendas y embarcaciones, y orientadas a las cosechas de frutos u otros usos. El Cuadro 1 presenta las principales especies taladas.
La acción de tala y quema con fines agrícolas en los terrenos de colina, es racionada y periódica. En sus migraciones, los grupos humanos nativos dejaron numerosas "purmas" (bosque bajo y denso conformado por plantas jóvenes), cuya edad según Gashe (op. cit.) oscila entre 5 y más de 30 años con fisonomía de bosque primario.
Los cultivos, básicamente, son yuca (Manihot esculenta),
incluyendo la variedad "yuca amarga", maíz (Zea mays),
shihuango (Renealmia sp.), pijuayo (Guilielma gasipaes), uvilla
(Pourouma cecropiaefolia), caimito (Pouteria guyanensis) y guava
(Inga edulis).
Cuadro 1.- Tala selectiva de algunas especies
forestales por los nativos humanos Secoya.
| Especies | Nombre vernacular | Utilización |
| Cedrela odorata | Cedro | Construcción de canoas |
| Cedrela sp. | Cedro | |
| Píthecellobium laetum | Remocaspi | Construcción de remos |
| Euterpe precatoria | Huasaí | Rajado para cercos de viviendas (malocas). Piso de las balsas en puertos. |
| Iriartea exorrhiza | Pona | Rajado y batido para pisos de algunas |
| viviendas (de influencia mestiza). | ||
| Iriartea ventricosa | Huacrapona | Construcción de canoas de emergencia. |
| Lepidocaryum tessmannii | Irapay | Construcción de "crisnejas" para techado de viviendas. |
| Jessenia batana en descomposición obtienen los "suri" (larvas de coleópteros). | Ungurahui | Para cosechar los frutos; de la médula |
| Mauritia flexuosa | Aguaje | Idem |
| Mauritia sp. | Aguaje | |
| Astrocaryum tucuma | Chambira | Para la extracción de los cogollos; las fibras se usan en textilería (confección de hamacas, bolsas, etc.). Los frutos inmaduros son cosechados. |
| Couma macrocarpa | Leche caspi | El látex es utilizado en cerámica para impermeabilizar vasijas y cántaros. |
| Los frutos se cosechan para comer. | ||
| Castilloa ulei | Caucho | El látex se usa para impermeabilizar bolsas, sacos y costales. |
| Dacryodes sp. | Copal | La resina se utiliza en el calafateo de canoas rajadas y averiadas. |
Fauna Silvestre
Entre los animales silvestres y los humanos nativos, existen relaciones estrechas y directas. La caza y captura son ejecutadas exclusivamente para la subsistencia. El carácter errante de las poblaciones es un factor que permite y facilita la recuperación y el equilibrio de la fauna silvestre en áreas adyacentes a los asentamientos humanos.
Aún se mantienen los métodos de caza tradicional. Se encuentran con frecuencia en el bosque trampas especiales preparadas con troncos delgados y camuflados con hojas y palmeras sujetadas con bejucos o tamshi (Heteropsis sp. y Carludovica sp.). Sin embargo, las armas de fuego (escopetas de cartuchos) están desplazando esas modalidades; por consiguiente, la incidencia de la caza se ha visto ligeramente incrementada. La carne, producto de la caza, es utilizada en la alimentación, mientras que algunas pieles y otros despojos son comercializados (Cuadros 2 y 3).
Cuadro 2.- Animales de caza en los grupos nativos
Secoya (cazados del 6 - 19 Agosto)
| Especies | Nombre | No Ind. | Alim. | Comerc. |
| Tapirus terrestris | Sachavaca | 2 | + | - |
| Tayassu pecarí | Huangana | 1 | + | Piel (seca) |
| Tayassu tajacu | Sajino | 3 | + | Piel (seca) |
| Dasyprocta variegata | Añuje | 7 | + | - |
| Lagothrix lagothricha | Choro, choruco | 5 | + | - |
| Cebus albifrons | Mono blanco, machín | 1 | + | - |
| Pithecia monachus | Huapo, huasuko | 1 | + | Cola (plumero) |
| Mitu salvini | Paujil | 1 | + | Plumas remeras (abanico) |
| Pipile cumanensis | Pava del monte | 1 | + | Idem |
| Penelope jacquacu | Pucacunga | 1 | + | - |
No. Ind. : Número de individuos
Alim. : Utilizados en la alimentación
Comerc.: Forma de comercialización de los productos.
Inventario de Primates No Humanos (*)
(*) En la actualidad, el alza de precios de insumos de caza (cartuchos, pólvora, fulminantes, etc.) es un factor que afecta progresivamente a las especies de mayor tamaño; además es un medio indirecto de protección de los animales de poca carne como mamíferos pequeños y las aves.
Los censos fueron cualitativos. El Cuadro 4 resume las formas de contacto y los tamaños de las manadas de cada especie. Las limitaciones logísticas y condiciones meteorológicas adversas, días lluviosos y descenso de la temperatura hasta 14oC, dificultaron la ejecución de censos cuantitativos. Sin embargo, la cercanía de las manadas a la visualización directa, nos indican la baja presión de caza hacia estos grupos y otras de la fauna de mediano y pequeño tamaño y volumen. Entre los monos, Lagothrix lagothricha, Cebus apella y C. albifrons serían las más vulnerables por la caza.
Cuadro 3.- Otros animales incluidos en la caza
. (información de los nativos Secoya).
| Especies | Nombre vernacular | Util. |
| Mazama americana |
Venado rojo |
A |
| Dinomys branickii |
Pacarana |
A |
| Ateles paniscus |
Maquisapa |
A |
| Cebus apella |
Mono negro |
A |
| Potos flavus |
Chosna |
A |
| Felis pardalis |
Tigrillo |
C (piel) |
| Mazama gouazoubira |
Venado gris |
A |
| Callicebus moloch |
Tocón |
A |
| Alouatta seniculus |
Coto |
A |
| Psophia leucoptera |
Trompetero |
A |
Los tucanes (Ramphastidae), loros (Amazona spp.) y guacamayos
(Ara macao, Ara spp.) son cazados para comer y con las plumas preparar sus atuendos
y adornos.
| Util.: | Utilización | A: Alimentación | C: Comercialización. |
Dos ejemplares (un juvenil y una cría) de sajino (Tayassu tajacu), una cría de huangana (Tayassu pecari); 3 ejemplares (dos infantes y un adulto) de mono choro (L. lagothricha), y uno de machín negro (Cebus apella), fueron encontrados como mascotas entre las familias Secoya.
Cebuella pygmaea. Se ubicó una manada de 3 ejemplares entre los bejucos y epífitos (Bromeliaceae), sostenidos por un árbol de Inga sp. Muy próximo a éste, encontramos árboles de Vochysia sp. y Spondias mombin con excavaciones en la corteza, efectuadas por los Cebuella para aprovechar la resina exudada.
Saguinus nigricollis nigricollis. Se observaron 5 manadas, cuyos
tamaños de grupo variaron de 2 a 6 individuos. En una de ellas se detectó
un infante con locomoción propia. Cuatro manadas fueron observadas en
la ribera y una en bosque de colina. Al advertir nuestra presencia, intentaron
acercarse, emitiendo "chirridos" similares a los S. fuscicollis
nigrifrons; mientras que la voz de alarma semeja a la de S. mystax (comparación
establecida por las experiencias durante los censos y capturas, y en el CRCP-Iquitos,
1976-1978). Además, ejecutaron rápidos movimientos de avance y
retroceso con la cabeza levantada y orientada hacia el observador. En ninguna
circunstancia se observó que tratasen de alcanzar las ramas altas de
los árboles del bosque.
Cuadro 4.- Censo cualitativo de primates
no humanos en el Río Yuvineto (Río Putumayo), Loreto, Perú.
Agosto 6-19,1978.
|
Especie |
Nombre vernacular |
M a n a d a |
pap |
Ua total |
|||||
|
Ubicación |
Tamaño | ||||||||
|
Vi |
Vó |
R |
C |
||||||
| Cebuella pygmaea | leoncito | 1 | - | 1 | - | + 3 | sí | no | 1 |
| Saguinus nigricollis | pichico | 5 | - | 4 | 1 | +3,6i,+3 | sí | no | 5 |
| S. n. nigricollis | +3,+2 | ||||||||
| Saguínus fuscicollis | pichico | 1 | - | - | 1 | 4 | sí 1 | no | 1 |
| S.f. tripartitus | |||||||||
| Cebus albifrons | machín | 2 | - | 2 | - | +3,+4 | sí | sí | 2 |
| C. a. yuracus? | blanco | ||||||||
| Saimíri sciureus | fraile | 5 | - | 5 | - | +20ic,15ic +10i,+5i +13i |
sí | no | 5 |
| Callicebus moloch | tocón | 1 | 1 | 2 | - | +2,? | sí | no | 2 |
| Pithecia monachus | huapo negro | 2 | - | 2 | - | 4,+3 | sí | sí | 2 |
| Lagothrix lagothricha | choro | 1 | - | - | 1 | 6c | no | sí | 1 |
| (+) | : | Manadas con conteo incompleto |
| Vi | : | Ubicación por visualización |
| Vo | : | Ubicación por voces |
| R | : | Ubicadas en orilla de río |
| C | : | Ubicadas en bosque de colina |
| pap | : | Ubicadas próximas y cercanas a centros poblados |
| Ua | : | Utilizados en alimentación |
| C | : | Cría sobre el dorso de la madre |
| i | Infantes-juveniles, locomoción propia. |
Saguinus fuscicollis tripartitus. Se localizó una manada entre las ramas inferiores de los árboles; los movimientos eran similares a los de S. f nigrifrons. Esta subespecie es fácilmente diferenciable del S. f nigrifrons por la presencia de la pequeña bifurcación blanca frontal y el color agutí intenso de la mitad posterior del cuerpo.
Cebus albifrons yuracus?. Muy próximo al poblado de Bellavista fueron avistadas 2 manadas, una de las cuales se encontraba asociada a Saimiri sciureus en la copa de Pithecellobium sp. (árbol de 7 a 9 m de altura con abundantes flores blancas). Al conteo efectuado de +3 y +4 (De esta manada fue cazada una hembra adulta; el cráneo y la piel se encuentran en la colección del CRCP-Iquitos) individuos, a una distancia de 30 a 40 m y a 8 m de altura, se aprecian los ejemplares de color ligeramente oscuro. La presencia del observador no los alteró notablemente, saltando de una rama a otra, con la cola erecta y emitiendo voces leves y continuas en aparente actitud de enfrentamiento o reconocimiento.
Saimiri sciureus (Se cazó una hembra adulta; al examen directo se nota ligero tamaño mayor, cabeza grisácea con dos mechones ("patches") bien definidos en el lado ínfero-póstero-auricular; además, el arco superciliar es negro y el arco supraauricular indiferenciado, los arcos circunoculares prominentes de color blanquecino, las orejas muy cortas. La piel y cráneo se encuentran en el CRCP, Iquitos). Se localizaron 5 manadas, cuyos tamaños eran de 5 a más de 20 individuos. Frecuentan los bosques inundables (tahuampas). A la observación directa, distancia de 10 a 20 m y 6 a 8 m de altura, los machos se veían grandes y robustos, con cabeza grisácea, dorso amarillento, partes laterales inferiores amarillentas y vientre blanquecino, cola con pelos en mechón denso y negro; las hembras presentan cabeza de color gris ligeramente más intenso que los machos, dorso amarillento, partes laterales amarillentas y vientre blanco-amarillento, y cola igualmente en mechón denso y negro. En 2 manadas se observaron infantes sobre el dorso de las madres, y en todas se contaron infantes (probablemente juveniles) con locomoción propia. En horas de la mañana frecuentaban las flores de Pithecellobium sp., probablemente para cazar insectos polinizadores o predatores de flores.
Callicebus moloch. La conducta sedentaria de esta especie permitió observar una manada y escuchar las voces de otra muy cercana al poblado de Bellavista. Habitan la ribera del río, entre los árboles con abundante follaje, bejucos y epífitos.
Pithecia monachus. Se ubicó 2 manadas, contándose 3 y 4 individuos; en la última se observó un ejemplar juvenil. No huyeron fácilmente del observador. Uno de los individuos (posiblemente un macho adulto) se expuso visiblemente, emitiendo vocalizaciones y caminando en todas direcciones con el pelaje erizado, dando un aspecto de mayor robustez. Este comportamiento de enfrentamiento permitió el acercamiento hasta casi 8 m de distancia perpendicular.
Lagothrix lagothricha. En un recorrido de 7 km hacia el NO del bosque alto (colina), entre los campamentos Ingano y Mamepó, fue localizada una manada con 6 ejemplares (incluyendo un infante-juvenil sobre el dorso de la madre); 2 de ellos ligeramente más robustos, de color tendiendo al marrón (posiblemente los machos). Se diferenciaban de otros 3, cuya coloración era negro-pálida. Esta manada fue hallada comiendo frutos de shimbillo de altura (Inga sp.) y de renaco (Árbol con frutos siconios de 8 a 10 mm de diámetro, pulposo, sabor dulce y utilizados también por los Secoya) (Ficus sp.). La conducta indiferente ante el observador permitió ubicarlos en los árboles en fructificación, a 12-18 m de altura.
Otras especies de Primates No Humanos. En las horas matutinas y en días nublados, se pudo percibir voces de 4 Alouatta seniculus. Los pobladores nativos nos indicaron la presencia en dicho lugar de musmuquis (Aotus sp..) y maquisapa (Ateles paniscus). Esta última especie visita las llamadas "colpas", donde son cazados.
Comercialización
La situación geográfica del Río Putumayo y la demarcación política del país, determina el aislamiento de esta cuenca. En consecuencia, la obtención de víveres, vestimentas, medicamentos, herramientas, etc., se lleva a cabo en la margen colombiana del río (procedente de Puerto Leguízamo, ver Fig. l); también allí se comercializan las pieles de huangana (Tayassu pecan) y la cola de huapo negro (Pithecia monachus). (Cuadros 2 y 4).
Se han registrado ingresos furtivos de extractores madereros y comerciantes de pieles de especies vedadas (por ejemplo, tigrillo Felis pardalis), provenientes del sector colombiano.
CONCLUSIONES
En los bosques adyacentes al Río Yuvineto, afluente derecho meridional del Río Putumayo, se puede encontrar Cebuella pygmaea, Saguinus nigricollis nigricollis, S. fuscicollis tripartitus, Cebus albifrons yuracus?, C. apella, Saimiri sciureus, Callicebus moloch, Pithecia monachus, Alouatta seniculus, Ateles paniscus, Lagothrix lagothricha y Aotus sp.
Además, entre otros animales, se encuentran representados los siguientes mamíferos: Tapirus terrestris, Tayassu tajacu, T. pecarl, Dasyprocta variegata , Diomys branickii, Mazama americana, M. gouazoubira, Felís pardalis, F. yagouaroundi, Potos flavus, Nasua nasua, entre otras; aves: Mitu salvini, Pipile cumanerisis, Penelope jacquacu, Psophia leucoptera, Ara macao, Amazona spp., Ramphastos spp., y otros Ramphastidae.
Los monos de tamaños mediano y grande (C. albifrons, C. apella, P. monachus, A. paniscus, y L. lagothricha) están expuestos a mayor presión de caza de subsistencia y/o a la utilización como cebos para la caza de tigrillos, por su conducta pacífica frente al observador o cazador.
Las especies forestales de valor comercial e industrial, están representadas por Cedrela odorata, Cedrela spp., Swietenia macrophylla, Castilloa ulei, Hevea brasiliensis, Hevea spp., Couma macrocarpa, y otras.
La margen derecha del Río Putumayo se halla poco afectada por la actividad agropecuaria, mientras que en la margen izquierda se observa intensa modificación del paisaje (por ejemplo, en Puerto Leguízamo, Colombia). La comercialización de subsistencias, pieles y mascotas, así como de maderas, es efectuada a través de la línea fronteriza del Río Putumayo.,
RECOMENDACIONES
Realizar observaciones similares en los centros poblados fronterizos de Yaguas, Estrecho, Puerto Arturo, Yabuyanos, Angusilla, Peneya, Güepí y Pantoja (frontera con Ecuador), e intermedios, y además a lo largo del curso del Río Napo, para reconocer las diferentes especies de flora y fauna silvestres y sus relaciones con los grupos nativos y colonizadores humanos en el ámbito del futuro Parque Nacional de Loreto, considerado zona de refugio del Pleistoceno (Vanzolini 1973).
Incentivar y apoyar los estudios etno-antropológicos de los diferentes grupos humanos nativos que habitan las cuencas de los Ríos Putumayo y Napo, porque ellos mantienen racionalmente el equilibrio del bosque (flora-fauna-hombre).
Divulgar los dispositivos legales de conservación y protección de la vida silvestre y ejercer mayor control sobre el comercio Ilícito de pieles de especies vedadas (por ejemplo, Felis pardalis), y coordinar el comercio interno de los productos de caza de otras especies.
Promover programas cívicos de apoyo para el abastecimiento de víveres, vestimenta, herramientas, medicamentos y combustible en el área fronteriza.
REFERENCIAS
Brack, A. 1975. Mapa de las Regiones Eco-Zoogeogrificas
del Perú. Lima.
Brack A. 1976. Ecología Animal. 1: Sinecología. Universidad
Nacional Agraria La Molina. Lima. 113 pp. -
Longman, K.A. y J. Jenik. 1974. Tropical forest and its environment. pp. 1-78.
En D.W. Ewer y M.D. Gwynne (Eds.). Tropical Ecology Series. Longman Group
Ltd., London.
Maneux, J. 1975. Mapa Forestal del Perú (Memoria Explicativa). Universidad
Nacional Agraria la Molina, Lima. 161 pp.Oficina Nacional de Evaluación
de Recursos Naturales (ONERN). 1976. Mapa Ecológico del Perú y
Guía Explicativa. Lima.
Prance, G.T. 1978. The terminology of Amazonian forest subject to inundation.
Resumos dos Trabalhos II Cong. Latin.-Am. Bot., Brazil. 274 pp.
Prance, C.T. 1978a. The origin and evolution of the Amazon Flora. Interciencia
30): 207-222.
Revilla, J. 1974. Descripción de los tipos de vegetación en Mishana,
Río Nanay, Loreto. Perú. PAHO Project AMRO 0719, Iquitos.
Sioli, H. 1974. Tropical rivers as expressions of their terrestrial environments.
pp. 275-288. En F.B. Colley y E. Medina (Eds.). Tropical Ecological Systems.
Trends in Terrestrial and Aquatic Research. Spinger Verlag, New York.
Vanzolini, P.E. 1973. Paleoclimates, relief, and species multiplication in Equatorial
Forests. pp. 255-258. En BJ. Meggers et al. (Eds.). Smithsonian Institution
Press. Washington, D.C.
ANALISIS POBLACIONAL DE Saguinus mystax (SPIX 1823) (CALLITRICHIDAE) EN LA CUENCA DEL RIO YARAPA, LORETO, PERU *
(*)Presentado en el Congreso Nacional de Biología, Chiclayo, Perú, Junio 1979.
Luis Moya, Lorgio Verdi, Gladys Bocanegra y Juan Rimachi.
INTRODUCCIÓN
Uno de los problemas en el manejo de primates en la Amazonía Peruana es el poco conocimiento que se tiene sobre la dinámica poblacional de estas especies. Estudios de dinámica poblacional de primates mayormente han sido desarrollados en el Viejo Mundo, donde entre otros se reportan trabajos sobre censos y estructura de edad y sexo (Southwick et al. 1965, 1970; Southwick y Sic1diql 1966; Southwick y Cadigan 1972); variaciones de peso (Berkson 1968), crecimiento y desarrollo (Schultz 1941). En el Nuevo Mundo, también se han realizado varios estudios ecológicos en varias especies de primates durante los años 1960-70, se mencionan a Mason (1966) en Callicebus moloch; Carpenter (1934) en Alouatta y Oppenheimer (1968) en Cebus capucinus, ambos en la Isla de Barro Colorado en Panamá; Klein y Klein (1976) en varias especies de primates colombianos; Moynihan (1976) en Cebuella pygmaea en la Amazonía Colombiana; Baldwin (1968) en Saimiri sciureus; entre otros.
Recientemente, se ha dado una mayor atención a la fauna primatológica de Sudamérica, reportándose trabajos principalmente sobre densidad poblacional y tamaño de manadas. Así, se tiene para el género Saguinus un estudio de S. nigricollis en Colombia por Izawa (1976) y censos poblacionales de S. fuscicollis en Perú (Freese 1975) y Bolivia (Heltne et al. 1976). En lo que respecta al Perú, se puede decir que a partir de 1972, las investigaciones primatológicas empiezan a cobrar importancia, debido en gran parte a la firma de un convenio internacional, lo que ha dado lugar a la formación del Comité Regional de Coordinación para el Proyecto Primates, con sede en la Ciudad de Iquitos, constituido por la Organización Panamericana de la Salud, el Ministerio de Agricultura, la Universidad Nacional Mayor de San Marcos (IVITA) y la Universidad Nacional de la Amazonía Peruana. A pesar de los avances científicos logrados hasta el presente, se ha dado poco énfasis a los estudios de dinámica poblacional, especialmente de S. mystax. Sin embargo, existen algunos estudios aislados de otros primates, siendo los más conocidos los censos poblacionales realizados por Freese et al. (1976) y Neville (1977) en todo el ámbito de la Amazonía Peruana, y los censos por Neville et al. (1976) en los Ríos Pacaya y Samiria. En este trabajo se analiza una población de S. mystax, una de las especies de mayor importancia biomédica, estudiada en la cuenca del Río Yarapa, afluente derecho del Río Amazonas.
DESCRIPCIÓN DEL ÁREA DE ESTUDIO
El Río Yarapa se localiza a 76º26'O y 04º27'S (Fig. 1). La cuenca corresponde a la eco-zoorregión de Selva Baja (Brack 1975, 1976) y a la zona de vida Bosque Húmedo Tropical (bh-T), con formación transicional a Bosque Muy Húmedo Tropical (bmh-T) (ONERN 1976). El Río Yarapa tiene aguas negras desde la desembocadura hasta la confluencia con la Quebrada Cumaceba (aproximadamente 18 km.). En este tramo su curso es más o menos paralelo al del Río Ucayali, zona de grandes estirones. Su orilla izquierda es inundable, de terrenos bajos, con una vegetación heterogénea y extensos "pungales" (predomina Bombax spp.), lagunas y zonas pantanosas. Aquí no se encuentra S. mystax. En la orilla derecha existen terrenos más elevados, denominados "restingas", entre pequeñas quebradas, ocupadas en su mayor parte por áreas de agricultura ("chacras") o bosques secundarios ("purmas") y entre las cuales se ubican los bosques temporalmente inundables y los extensos "aguajales", que son terrenos bajos y pantanosos en los que predominan las palmeras de aguaje (Mauritia flexuosa). En este sector, S. mystax tiene amplia distribución.
El Yarapa, a partir de la confluencia con la Quebrada Cumaceba hacia su cabecera, tiene un recorrido serpenteante. El terreno es inundable cerca a las orillas; el terreno colinoso se presenta por sectores, presentando colinas más altas conforme se avanza hacia las cabeceras. Sus aguas son típicas de quebrada y poco navegables. En esta zona, la distribución de S. Mystax abarca ambas orillas.
MATERIALES Y MÉTODOS
Los datos se obtuvieron principalmente por dos modalidades: por observaciones directas en el terreno, utilizando binoculares (7 x 35) y por atrapamientos. Para esta última, se empleó la trampa tipo "Saguinus" (Encarnación et al., este volumen). La trampa es una estructura de madera de 120 a 150 cm de largo, 40 cm de ancho y 36 cm de alto, cubierta de malla metálica galvanizada con cocada de 1/4 y 1/2 pulgada. Está divida en 8 a 10 celdas sucesivas, separadas por malla metálica de 1/4 de pulgada. El ancho de luz de cada celda es de 12 a 14 cm; están provistas de puertecillas que se cierran y abren por la acción de tiras de jebe, e hilos de nylon # 14 de 8 a 12 m de longitud (Fig. 2). Estos hilos están sujetados a las puertecillas para ser manipulados desde un puesto de observación (Fig. 3). Las fases del atrapamiento son descritos por Encarnación et al. (este volumen).
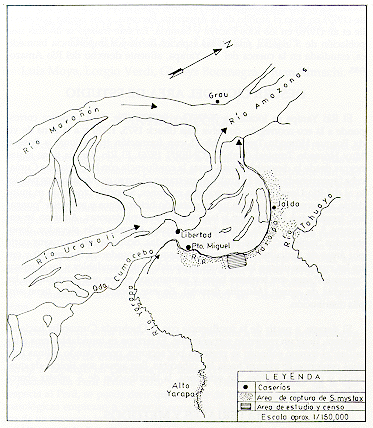
Fig.1. - Ubicación de cuenca del Río Yarapa
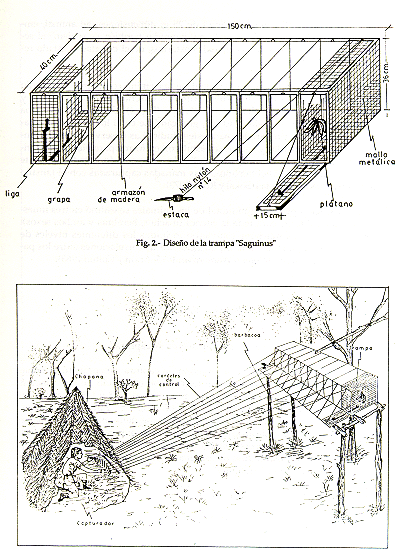
Fig. 3. - Método de captura de S. mystax
Se procuró atrapar manadas completas. Al momento de la captura se registraron los siguientes datos: hora, fecha, tamaño de la manada y comportamiento de los animales durante en procesos de captura. Luego en el campamento se registró el peso de cada animal, empleando una balanza de resorte marca CHATILLON, con sensibilidad de 25 g; dimensiones del animal, empleando tablas de medición y regla milimetrada; también se registró el sexo, grado de desarrollo de los genitales externos, nivel de edad y estado reproductivo de las hembras.
Para estimar la densidad poblacional, se determinó como área de estudio una extensión de 1,9 km2 de terreno entre los Caseríos de Puerto Miguel y Jalda, en la margen derecha del Río Yarapa (Fig. 4). Se levantó un mapa del área de estudio a escala 1/10 000, graficándose en él los transectos o caminos existentes, o preparados para este estudio. Las observaciones de campo, captura de manadas y censos se ejecutaron en forma paralela. La efectividad del método de captura fue analizada comparando estadísticamente (prueba t, con p = 0,05) el tamaño de las manadas capturadas con el tamaño de las manadas observadas (Sokal y Rohlf 1973).
La correlación peso-longitud total de los animales se estimó en tres muestras tomadas al azar, para toda la cuenca (machos, hembras y ambos sexos). En cada una de las muestras estuvieron incluidos los diferentes niveles de edad. Se comprobó el nivel de significación de las correlaciones entre los parámetros mencionados. (Neter y Wasserman 1975, Arkin y Colton 1963).
RESULTADOS
Tamaño de manadas y efectividad del método de captura
Para evaluar la efectividad del método de captura, se comparó el tamaño de las manadas observadas en el terreno con el tamaño de las manadas capturadas. Las muestras totalizaron 60 manadas, con 278 y 226 animales, teniendo un tamaño promedio de 4,63 ± 2,07 y 3,77 ± 2,01 (DE) animales, respectivamente (Cuadro l). El tamaño modal fue de 5 animales por manada. Comparadas estadísticamente las muestras por observación y por captura, se comprobó que no existe diferencia significativa entre ellas (t = 1,94, p > 0,05, 116GL); demostrándose de esta manera la gran eficiencia del método de captura con la trampa'Saguinus'.
Estructura poblacional por edad y sexo
La categorización por edad y sexo de los
individuos de la población muestreada se realizó tomando como
criterio el peso, longitud total y grado de desarrollo de los genitales. Los
resultados de la estructura poblacional se muestran en el Cuadro 2. Los adultos
comprendieron el 77,4% de la muestra total, de los que el 82,6% fueron machos
y 72,1 % de hembras. Los sub adultos representaron el 10,6% del total, con 6,1%
de machos y 15,3% de hembras. Los juveniles comprendieron el 7,5%, con 8,77o
de machos y 6,3% de hembras. Finalmente, los infantes representaron el 4,5%
de la muestra total, con 2,6% de machos y 6,3% de hembras. La proporción
macho/hembra en la muestra total fue 1,04:1,0, que indica un equilibrio de sexos
en la población.
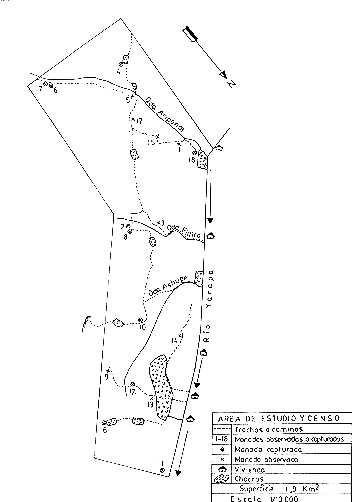
Fig. 4. - Area del Estudio y Censo
Cuadro 1.- Distribución de frecuencias
del, tamaño de las unidades sociales de Saguinus mystax en las muestras
capturadas y observadas en el Río Yarapa entre Junio y Octubre de 1978.
| N°Animales por unidad social |
Unidades observadas |
Unidades capturadas |
Total Observados |
animales Capturados |
| 1 | 3 | 10 | 3 | 10 |
| 2 | 8 | 11 | 16 | 2 |
| 3 | 8 | 6 | 24 | 18 |
| 4 | 10 | 9 | 40 | 36 |
| 5 | 10 | 12 | 50 | 60 |
| 6 | 9 | 6 | 54 | 36 |
| 7 | 8 | 4 | 56 | 28 |
| 8 | 2 | 2 | 16 | 16 |
| 9 | 1 | - | 9 | -- |
| 10 | - | 10 | -- | |
| TOTAL | 60 | 60 | 278 | 226 |
| X | -- | -- | 4,63 ± 2,07 | 3,77± 2,01 |
Cuadro 2.- Composición por edad y sexo de la muestra poblacional de S.
Mystax (N = 60 manadas).
|
Nivel de edad |
Machos |
Hembras |
Relación |
Total |
|||
|
N |
% |
N |
% |
N |
% |
||
| Adultos | 95 | 82,6 | 80 | 72,1 | 1,18: 1,0 | 175 | 77,4 |
| Subadultos | 7 | 6,1 | 17 | 15,3 | 0,41: 1,0 | 24 | 10,6 |
| juveniles | 10 | 8,7 | 7 | 6,3 | 1,41: 1,0 | 17 | 7,5 |
|
Infantes |
3 |
2,6 |
7 |
6,3 |
0,42: 1,0 |
10 |
4,5 |
| TOTAL: | 115 | 100,0 | 111 | 100,0 | 1,036: 1,0 | 226 | 100,0 |
Relación peso-longitud total
Los promedios de peso y longitud total de los machos y de las hembras indican la existencia de dimorfismo sexual de tamaño en esta especie, siendo las hembras más grandes que los machos. El peso promedio de hembras adultas fue de 511,3 g y el de machos 491,2 g; la longitud total promedio de hembras adultas fue de 620,3 mm y el de machos de 611,8 mm (Cuadro 3).
M analizar la correlación de peso M y longitud (X), en tres muestras tomadas al azar, de machos (Fig. 5), hembras (Fig. 6) y de ambos sexos (Fig. 7), se observó que las distribuciones de los respectivos datos siguieron la forma exponencial, por lo que previamente los datos se transformaron a una regresión lineal, usando el método de ajustes logarítmicos del modelo estadístico log yi= log a b log xi. Se comprobó una alta correlación entre los parámetros mencionados anteriormente. Así para los machos, r = 0,808 (p = 0,01, CL 30); para las hembras, r-- 0,977 (p = 0,01, CL 34); y para ambos sexos, r = 0,809 (p = 0,01, CL 32).
Densidad y biomasa poblacional
La densidad poblacional fue estimada ubicando todas las manadas
existentes dentro del área de estudio de 1,9 km2 (Fig. 4). El número
total de manadas encontradas fue 18, de las cuales 10 fueron capturadas y 8
censadas mediante observación directa en el terreno (Cuadro 4). El número
total de animales contados fue 82, lo que nos da una densidad de 43,2 animales/km2
y 9,5 manadas/km2. En vista que los territorios de las manadas estaban sólo
parcialmente contenidos en el área de estudio, las cifras expuestas,
estiman la densidad máxima, es decir, aquella densidad cuando todas las
manadas censadas se encuentran simultáneamente dentro del área
de estudio. Teniendo en cuenta la estructura de edad de la población
en estudio y los pesos promedio por edad específica (ambos sexos), los
82 individuos arrojaron un peso total de 37,42 kg lo que equivale a una biomasa
de 19,7 kg/km2 (Cuadro 5).
Cuadro 3.- Pesoylongitud total promedio por edad y sexo de ejemplares de 60 manadas de S. mystax examinados en el Río Yarapa.
|
Nivel de edad |
Machos | Hembras | ||
|
Peso (g) |
Long. total (mm) |
Peso (g) |
Long. total (mm) | |
|
i± DE (N) |
X±DE(N) |
T±DEN |
R±DE |
|
| Adultos | 491 ± 23 (95) | 611,8 ±31,2 | 511±49 (80) | 620,3 ± 29,0 |
| Subadultos | 369±54(7) | 570,4±35,9 | 422±46(17) | 605,8±33,7 |
| juveniles | 280±61(10) | 509,2±75,8 | 254±46(7) | 529,3±44,4 |
| Infantes | 190±10(3) | 459,7±7,5 | 159±76(7) | 405,2±122,0 |
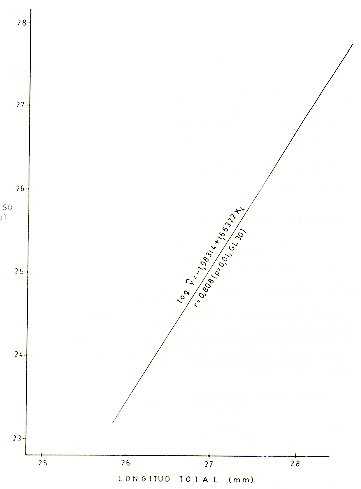
Fig. 5.- Correlación perso-longitu total, con transformación
logarítmica en
S. mystax machos
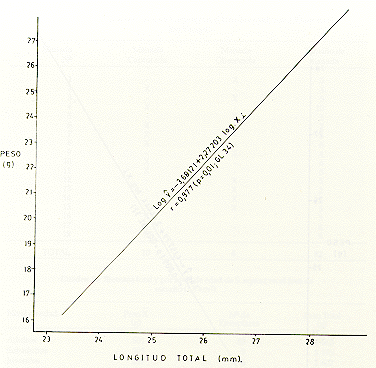
Fig. 6.-Correlación peso-longitud total, con transformación logarítmica en S. mystax hembras.
DISCUSIÓN
El tamaño de las manadas en la muestra obtenida por observación directa en el terreno oscila entre 1 a 10 ejemplares, con un promedio de 4,6; el tamaño obtenido por capturas varía entre 1 y 8, con un promedio de 3,8 (Cuadro l). Castro y Soini (1977) señalan que el tamaño de manada varía entre 2 y 6 individuos en la zona del Río Tahuayo (Loreto). Soini y Soini (este volumen), en observaciones realizadas a lo largo del Río Manití, reportan variaciones entre 2 y 12 ejemplares; sin embargo consideran que el elevado tamaño de algunas manadas, posiblemente sea por asociaciones temporales de dos manadas. En este estudio también se observaron animales solitarios, que posiblemente estaban buscando formar una nueva manada, o que habían sido expulsados de su tropa original. En las 60 manadas capturadas se observó que aparentemente sólo 31 contenían una pareja reproductora, también denominada pareja "alfa".
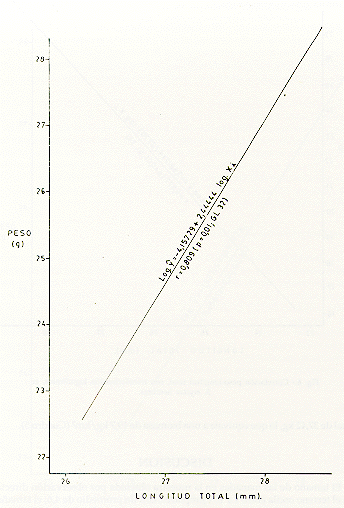
Fig. 7.- Correlación peso-longitud total, con transformación logarítmica, en S mystax de ambos sexos.
Cuadro 4.- Manadas censadas de S. Mystax
en el área de estudio de 1,9 km2 en el Río Yarapa
| Manada N° | Manada Capturada | Manada Observada | Tamaño de manada |
| 1 | - | X | 5 |
| 2 | X | - | 3 |
| 3 | - | X | 5 |
| 4 | X | - | 10 |
| 5 | - | X | 5 |
| 6 | X | - | 2 |
| 7 | X | - | 3 |
| 8 | X | - | 6 |
| 9 | - | X | 4 |
| 10 | X | - | 6 |
| 11 | X | - | 5 |
| 12 | - | X | 5 |
| 13 | - | X | 2 |
| 14 | - | X | 3 |
| 15 | - | X | 5 |
| 16 | X | - | 5 |
| 17 | X | - | 4 |
| 18 | X | - | 4 |
| TOTAL | 10 | 8 | 82 |
Cuadro 5.- Biomasa total y por nivel de edad de S. mYStax en el área
de estudio (1,9 km2).
|
Nivel de edad |
Pew |
hP de |
Peso Total |
|
(g) |
Ejemplares |
||
| Adultos | 501 | 63 | 31, 563 |
| Subadultos | 395 | 9 | 3, 555 |
| juveniles | 267 | 6 | 1, 602 |
| Infantes | 175 | 4 | 700 |
|
TOTAL |
82 |
37, 420 |
La metodología de captura con trampa "Saguinus" es muy eficiente; esto queda demostrado al comparar la muestra obtenida por este método con aquella obtenida por simple observación directa (Cuadro D. De acuerdo a Soini y Soini (este volumen) S. mystax presenta una temporada principal de nacimientos desde Noviembre a Febrero. Durante el desarrollo del presente trabajo, se encontró dos hembras en avanzado estado de preñez, capturadas el 21 de Agosto en el área de Puerto Miguel y el 22 de Setiembre en Jalda, respectivamente. Estas observaciones corroboran lo reportado por Soini y Soini (este volumen) de que también fuera de la temporada principal de nacimientos nacen algunas camadas.
El perfil poblacional muestra la forma de una pirámide de base invertida, correspondiendo los máximos porcentajes a los adultos, tanto en la muestra total (77,4%) como por sexos (en machos 82,6% y en hembras 72,1%). La elevada proporción de individuos adultos es debido a que en este nivel de edad se incluyen individuos provenientes de varios años. Esta desproporcionalidad indica, además que en las manadas no todas las hembras reproducen, sino que probablemente sólo una hembra, por regla general, es reproductivamente activa en cada manada.
Los trabajos que se ejecutan en el marco del Proyecto Peruano de Primatología, por las evaluaciones y censos, y mediante el manejo de la especie, han permitido obtener conocimientos sobre la estructura poblacional en algunos lugares y por temporadas cortas. Por este motivo, se hace imprescindible intensificar estos estudios que permitan interpretar la dinámica poblacional de estos primates en diferentes ambientes de la Amazonía Peruana.
El dimorfismo sexual de esta especie se refleja en el peso y la longitud total. Estos dos parámetros se correlacionan fuertemente en las tres muestras: machos, hembras y ambos sexos (Figs. 5, 6, y 7). Proyectando los valores promedios de peso y longitud total para cada una de las categorías de edad sobre la recta de regresión o predicción, se pueden establecer los límites mínimos y máximos de confianza; inversamente, determinando los límites antes mencionados, éstos pueden ser de ayuda para estimar los niveles de edad de los animales silvestres de S. mystax.
Los estimados de densidad y biomasa obtenidos en el presente estudio son mayores a los reportados por Soini y Soini (este volumen) para el Río Manití, donde la densidad ecológica fue estimada en 23 ind./km2 o 4,5 man./km2, y la biomasa en 11,5 kg/km2. Es conveniente hacer notar que estos dos estimados de densidad no son estrictamente comparables, ya que la cifra obtenida en el presente estudio estima la máxima densidad.
RESUMEN
Se realizó un análisis poblacional de Saguinus mystax (Spix 1823) en la cuenca del Río Yarapa, afluente derecho del Río Amazonas, desde el 8 de junio al 22 de Octubre 1978. Los datos fueron obtenidos por dos modalidades: por observaciones directas y por capturas, debido a que demuestra una gran efectividad el método de trampeo (t = 1,94, p> 0,05, 116 GL). El análisis ha enfocado cuatro aspectos de la población: tamaño de la manada, estructura por edad y sexo, relación peso-longitud total, densidad y biomasa poblacional. El tamaño promedio de la manada en cada una de las modalidades fue 4,63 y 3,77 ind./man., respectivamente. Los animales adultos comprendieron el 77,4% de la población muestrada, con una proporción macho/hembra de 1,18:1,0. Se encontró dimorfismo sexual en peso y longitud total entre hembras y machos, siendo las primeras más grandes. Se verificó una correlación significativa muy alta entre los parámetros peso y longitud en muestras de machos, hembras y ambos sexos (p = 0,01); la densidad y biomasa fueron estudiadas en un área representativa de la cuenca de 1,9 km2. En esta área se estimó una densidad máxima de 43,2 ind./km2 y 9,5 man./km2, y una biomasa de 19,7 kg/km2.
REFERENCIAS
Arkin, H. y R. Colton. 1963. Tables for statisticians. 2nd.
Ed., Barnes & Noble Books, New York. 168 pp.
Baldwin, J.D. 1968. The social behavior of adult male squirrel monkeys (Saimiri
sciureus) in a seminatural environment. Falia Primatol. 11: 35-79.
Berkson, C. 1968. Weight and tooth development during the first year in Macaca
lrus. Lab. Anim. Care 18(3):352-355.
Brack, A. 1975. Mapa de las Regiones Eco-Zoogeográficas del Perú,
Lima.
Brack, A. 1976. Ecología animal. L Sinecología. Universidad
Nacional Agraria la Molina, Lima. 113 pp.
Carpenter, C. 1934. A field study of the behavior and social relations of howling
monkeys. Comp. Psychol. Monograph 10(2):1-168.
Castro, R. y P. Soini. 1977. Field studies. of Saguinus mystax and other
Callitrichids in Amazonian Peru. pp. 73-68. En D.C. Kleiman (Ed.). The Biology
and Conservation of the Callitrichidae. Smithsonian Inst. Press, Washington,
D.C.
Encarnación, F., L. Moya, P. Soini, J. Tapia y R. Aquino (este volumen).
Captura de Callitrichidae (Saguinus y Cebuella) en la Amazonia Peruana.
Freese, C. 1975. A census of nonhuman primates in Peru. Report to the OPS, and
National Academy of Science. 25 pp.
Freese, C., M. Neville, R. Castro y N. Castro. 1976.
The conservation status of Peruvian Primates. Lab. Primate News. 15(3):1-9.
Heltne, P., C. Freese y G. Whitesides. 1976. A field survey of nonhuman primates
populations in Bolivia. PAHO, Washington, D.C. 40 pp.
Izawa, K. 1976. Croup sizes and composition on monkeys in the upper Amazon basin.
Primates 17(3): 367 - 399.
Klein, L.L. y D.J. Klein. 1976. Neotropical primates: aspects of habitat usage,
population, density, and regional distribution in La Macarena, Colombia. pp.
70-78. En R.W. Thorington, Jr. y P.C. Heltne (Eds.). Neotropical Primates.
National Academy of Sciences, Washington, D.C.
Mason, W. 1966. Social organization of the South American monkeys Callicebus
moloch. A preliminary report. Tulane Studies in Zool. 13:23-28.
Moynihan, M. 1976. Notes on the ecology and behavior of the pygmy marmoset Cebuella
pygmaea in Amazonian Colombia. pp. 7M4. En R.W. Thorington, Jr. y P.C. Heltne
(Eds.). Neotropical Primates. National Academy of Sciences, Washington,
D.C.
Neter, J. y W. Wasserman. 1973. Applied linear statistical models. Richard D.
Irvin, Inc. Illinois. 842 Pp.
Nieville, M. 1977. Censo de primates en el Perú. En Primera Conferencia
Interamericana sobre la Conservación y Utilización de Primates
Americanos No Humanos en las Investigaciones Biomédicas. (Lima, Penú,
2-4 Jun. 1975). OPS, Wash., D.C. Publ. Cient. 317:20-31.
Neville, M., N. Castro, A. Marmol y J. Revilla. 1976. Censusing primate populations
in the Reserved Area of the Pacaya and Samiria Rivers, Department Loreto, Peru.
Primates 17(2):151-181.
Oficina Nacional de Evaluación de Recursos Naturales (ONERN). 1976. Mapa
Ecológico del Perú y Guía explicativa. Lima.
Oppenheimer, J.R. 1968. Behavior and ecology of the white-faced monkey, Cebus
capucinus on Barro Colorado Island, CZ Ph. D. thesis, University of Illinois,
Urbana. 179 pp.
Schultz, A. 1941. Growth and development of the orangutan. Carnegie Inst.
Washington, Public. 525; Contribution to Embriology 29 (82):57-110.
Soini, P. y M. Soini (este volumen). Ecología poblacional de Saguinus
mystax (Callitrichidae, Primates).
Sokal, R. y J. Rohlf. 1973. Introduction to biostatistics. W.H. Freeman and
Company, San Francisco. 368 pp.
Southwick, C., M. Beg y R. Siddicli. 1965. Rhesus monkeys in North India. pp.
111159. En DeVore (Ed.). Primate Behavior. New York, Holt, Rinehart y
Winston.
Southwick, C. y F. Cadigan. 1972. Population studies of Malaysian primates.
Primates 13:1-18.
Southwick, C. y R. Siddicli. 1966. Population changes of rhesus monkeys (Macaca
mulatta) in India, 1959 to 1965. Primates 7:303-314.
Southwick, C., R. Siddicli y F. Siddicli. 1970. Primate populations and biomedical
research. Science 170:1051-1054.

RECONOCIMIENTO Y CENSO DEL GUAPO COLORADO (Cacajao calvus rubicundus) EN EL ORIENTE PERUANO*
(*) Estudio ejecutado con apoyo del Comité de Conservación de la Sociedad Zoológica de Nueva York y el Proyecto Peruano de Primatología.
Roy Fontaine
INTRODUCCION
Este documento resume las observaciones que realicé entre Setiembre y Octubre 1978 (transición de la estación seca a la estación lluviosa) sobre la situación del huapo rojo en la cuenca del Río Tapiche, Provincia de Requena, Loreto.
Los objetivos originales de la investigación incluían la obtención de información sobre ubicación de poblaciones, preferencias de hábitat, dieta, y sinecología en relación al huapo colorado. Además, se pretendía realizar una indagación de la factibilidad de un estudio sostenido en el medio natural. El plan original fue recorrer los principales afluentes de la margen oriental del Río Ucayali entre Requena y Pucallpa. Sin embargo, por falta de tiempo y facilidades logísticas, las actividades fueron restringidas al Río Tapiche y sus afluentes el Río Blanco y Quebrada Yanayacu (Fig. D, que cubren un área de aproximadamente el tamaño de Maryland.
En vista que transcurría mucho tiempo entre cada encuentro con grupos de huapos, se realizaron también observaciones de otros primates, así como de otros mamíferos grandes y de la avifauna.
METODOLOGÍA
Utilicé varios métodos para ubicar
y censar grupos de Cébidos. Algunas de las observaciones se realizaron
desde botes, así en el Río Blanco con un pequeño bote motor
para el reconocimiento y censo de las riberas, surcando y bajando con motor
en marcha mínima o bajando con la corriente y motor apagado. En la Quebrada
Yanayacu y en un canal de aguas negras, ubicado cerca del Río Blanco,
para el censo de riberas empleé canoa. Para los censos desde bote o canoa
anoté las horas recorridas. El bosque interior fue censado a pie. En
los principales lugares de estudio, recorrí repetidamente las demás
trochas, lo que permitía travesías más rápidas y
silenciosas. Las distancias recorridas se estimaron mediante el conteo de pasos,
que luego sirvieron de base para una estimación aproximada de la densidad
de monos en las dos áreas principales de estudio.
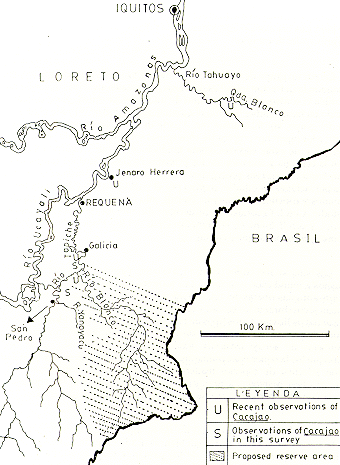
Fig.1. - Mapa del área de reconocimiento
y censo U = observaciones recientes de Cacajo;
S = observaciones de Cacajo en este estudio. Area punteada = reserva propuesta.
Censar un grupo de monos requiere la observación visual del mismo, pero a menudo la detección inicial es más bien por señales auditivas. Cuando no fue posible el conteo de los integrantes de un grupo, se estimó el tamaño aproximado en base a indicios como el movimiento de follaje durante el alejamiento del grupo, vocalizaciones, etc. Aparte de las observaciones de campo, inquirí a los lugareños empleados como guías sobre ubicación de poblaciones de Cacajao y de otras especies, como también sobre otros tópicos relacionados con la ecología y situación de los primates locales. Todos los censos se hicieron fuera de reservas protegidas, por lo tanto la presión de caza afectaba a las poblaciones en estudio, motivo por el cual la mayoría de los monos eran tímidos y difíciles de observar. Trabajé sólo en mis dos áreas principales de estudio. Con 1. Constable, R. Mittermeir durante los recorridos y censos iniciales, y con P. Soini, en las inmediaciones del Río Blanco, durante todos los censos y recorridos a pie y en bote.
Los bosques recorridos o censados estaban permanentemente Inundados o sujetos a inundación estacional. Los terrenos más elevados y secos se ubican sobre antiguas riberas del río, llamados localmente restingas. Aun cuando estaban secos durante los censos y recorridos, éstos se Inundaban en la temporada anual de lluvias. Otros tipos de bosques censados o recorridos Incluían bosques de pantano y aguajales; este último poblado predominantemente por palmeras de aguaje (Mauritía flexuosa), y piso conteniendo aguas negras. Aunque los bosques eran primarios, las restingas y riberas sufrieron la extracción selectiva de especies maderables, como lupuna (Ceiba pentandra), cedro (Cedrela adorata), caoba (Swietenia sp). Sin embargo, los aguajales parecían intactos, porque normalmente no contienen especies maderables.
El Tapiche es conocido corno un río de aguas negras; sin embargo, en la estación seca sus aguas se tornan blancas. En la estación lluviosa, este río es alimentado por aguas negras de los pantanos y aguajales. En cambio, las aguas del Río Blanco y Quebrada Yanayacu son negras durante todo el año. Estos ríos de aguas negras son notorios por su escasa fauna acuática.
RESULTADOS
Reconocimiento inicial
La primera fase de este estudio comprendió del 02 al 12 de Setiembre 1978. Consistió en muchas exploraciones a motor por río y breves recorridos en lugares seleccionados a lo largo del Tapiche. Entre el 03 y 04 de Setiembre, con Mittermeir y Constable, recorrimos unos 15,2 km de trocha en el bosque situado aguas arriba de Galicia, donde los lugareños nos informaron que habían observado Cacajao. Nosotros no contactamos con monos en este recorrido, excepto un grupo de S. fuscicollis cerca a nuestro campamento. Después viajamos cerca al Caserío San Pedro, ubicado en la confluencia del Yanayacu. con el Tapiche.
El 06 de Setiembre, recorrimos 4 km de trocha en el bosque y durante tres horas censamos las orillas del Yanayacu. Desafortunadamente, no observamos monos durante estos censos; sin embargo, fuera del período de censo vimos Aotus sp., Cebuella pygmaea y S. fuscicollis. Nuestra siguiente tarea fue regresar al Río Blanco y luego surcar hasta donde la navegación era posible. Aparte de 4 ejemplares muertos de Lagothrix lagothricha, en poder de un cazador, no observamos más durante esta excursión. Después de retornar a la boca del Río Blanco, censamos 9 km de trochas en la margen occidental de este río, pero no conseguimos ver monos en este recorrido. Posteriormente, regresamos a San Pedro, para reunirnos con P. Soini, naturalista afiliado al Proyecto Primates, y continuar nuestra exploración de los bosques en la margen oriental del Tapiche. Entre el 9 y 10 de Setiembre, recorrimos 14,5 km por bosque de pantano y aguajales cercanos a San Pedro. En este tramo, localizamos un grupo mixto de S. mystax y S. fuscicollis. El 11 de Setiembre, repetí los recorridos de los dos días anteriores, encontrando un grupo muy temeroso de 6 ejemplares de Cebus apella.
El censo en aguajal de San Pedro y las orillas del Yanayacu
La segunda fase del reconocimiento y censo se inició cuando Mittermeir y Constable retornaron a Iquitos. Por sugerencia de un cazador conocedor del área, decidí trabajar intensivamente en un aguajal y en las restingas circundantes, ubicadas a varios kilómetros aguas arriba de la boca del Yanayacu. Del 13 de Setiembre al 04 de Octubre, recorrí repetidamente el sistema de trochas viejas aperturadas por cazadores y trochas nuevas abiertas para este estudio. Además, censé en canoa las orillas del Yanayacu.
Este período de estudio resultó más productivo que el de reconocimiento y de censos más dispersos. En el transcurso de aproximadamente 10 km de recorrido por restingas y 32 km por aguajales, observé los siguientes primates: C. c. rubicundus con aproximadamente 30 ejemplares; Pithecia hirsuta con 4; C. apella con 8; un grupo mixto de C. apella y Saimiri sciureus con 12 y 30 ejemplares, respectivamente, y un grupo de Alouatta seniculus con 6 ejemplares. En cambio, en 24 horas de censo de las orillas M Yanayacu no se encontraron monos. El guía informó haber observado C. albifrons, Lagothrix y Ateles en este aguajal, pero que estos monos eran escasos.
Los grupos de Cebus, Saimiri y Alouatta fueron localizados en el interior del aguajal; el grupo de Pithecia estaba en el bosque pantanoso mixto de la orilla del aguajal, y el grupo de Cacajao fue visto primero en una restinga, para luego huir al aguajal cercano después de detectar al observador.
El censo cerca de la boca de Río Blanco
El 8 de Octubre viajé río abajo, para censar la orilla occidental del Tapiche y el Río Blanco. Con la colaboración de Soini, recorrimos la margen occidental del Río Blanco, durante 2 días y por aproximadamente 12 h, pero no se observó ningún Cacajao. Un recorrido adicional de 3 h en canoa en la misma área general tampoco produjo resultados positivos. Luego, se surcó el Río Blanco en bote lento, por 5:30 h, contactando con grupos de S. mystax en la orilla oriental y un grupo mixto con 6 S. mystax y 1 S. fuscicollis en la orilla occidental. Después de 4:30 h de bajada por el Río Blanco, pudimos ver un grupo de S. mystax y otro de P. hirsuta en la orilla occidental del río.
Durante la última fase del estudio (12-18 de Octubre) realicé un censo intensivo en el bosque de la margen occidental del Tapiche, cerca de su confluencia con el Blanco. Recorrí repetidamente la ruta que establecí en el primer día de este censo. Este sistema de trochas atravesaba bosques pantanosos y restingas, y bordeaba un aguajal grande. En 56 km de recorridos, realizados en 34h, se tuvo encuentros con dos grupos de S. sciureus (uno con aproximadamente 15 y otro de aproximadamente 50); Aotus (4 individuos, activos a las 11:00 a.m., lo que es muy anormal para este mono nocturno), dos encuentros con 3 S. fuscicollis (ambos en la misma área general, siendo probablemente el mismo grupo en ambos casos) y un breve encuentro con Cacajao. También escuché rugidos de Alouatta seniculus en dos oportunidades. El guía había visto anteriormente C. apella, C. albifrons y L. lagothricha en el área censada.
En el breve encuentro con Cacajao, conté 3 individuos (hembras adultas o machos subadultos) a una altura de 15 m sobre el suelo; eran probablemente integrantes de un grupo mayor.
Todos los monos observados en esta área huyeron rápidamente al detectar la presencia del observador; daban la impresión de ser aún más tímidos que los monos observados en la otra área de estudio intensivo.
Estimaciones de densidad
Considerando el sistema de trochas como un transecto, con una distancia lateral de detección de 100'm, se puede convertir los kilómetros recorridos en km2 censados. Con este método, la densidad de monos en el área de] aguajal de San Pedro se estimó en 1,43 grupos/km2 y la densidad en el bosque de la margen occidental del Tapiche, cerca de su confluencia con el Blanco, en 0,89 grupo/km2.
Una mayor presión de caza (sugerida por la mayor timidez de los animales) puede ser la causa de la menor densidad de monos en la segunda área. No obstante, el error de muestreo, diferencias de hábitat y diferencias en la composición de las poblaciones, no pueden ser descartados como posibles causantes de la diferencia reportada aquí.
Otras especies de fauna silvestre en la cuenca del Tapiche
Aunque los monos fueron un componente importante de la fauna de la cuenca del Tapiche, los mamíferos grandes de mayor abundancia son probablemente los delfines del río (Sotalia fluviatilis e Inia geoffrensis). Además, Hydrochoerus hydrochaeris era particularmente abundante en las orillas del río. Todas estas especies eran ignoradas por los cazadores, debido, según decían, a la mala calidad de su carne. Entre otros mamíferos, se observó: Tamandua tetradactyla, Cyclopes didactylus (atrapado por un gavilán Morphnus guianensis), Sciurus sp., Agouti paca, Nasua nasua, Eira barbara y Mazama sp. También se observó rastros de Tapirus terrestris, Felis pardalis y de Panthera onca.
DISCUSIÓN
Desafortunadamente, fue poca la información básica que se obtuvo en este estudio sobre la ecología del Cacajao. Su timidez y tendencia a evitar las riberas de los ríos en la estación seca contribuyeron a ello. Como mencioné anteriormente, el censo por canoa en Yanayacu resultó notablemente infructuoso. Posteriormente, los lugareños me informaron que Cacajao y las otras especies de primates se congregan a las orillas del río entre Marzo y Abril para alimentarse de Inga spp. y quinilla, nombre local de varias especies de Rubiaceae, incluyendo Bothríospora corymbosa, Duroia longifolia y Warscewiczia coccinea (Williams 1936). Durante la estación seca los huapos se trasladan al interior de los aguajales, donde es difícil ubicarlos. Este patrón estacional de uso del área domiciliaria, implica que Cacajao ocupa un área muy amplia, tal vez de varios kilómetros cuadrados.
La aparente restricción de Cacajao a los bosques con pantano de aguas negras, sugiere que la especie posee adaptaciones específicas para este tipo de bosque. Su subsistencia en estas áreas tal vez se debe a la capacidad de consumir alimentos que otros monos no utilizan o que son capaces de aprovecharlos antes que estén disponibles a los competidores potenciales, por ejemplo, mediante especialización en frutos verdes (Mittermeir, comunicación personal).
Estos resultados, las observaciones de Soini e informaciones de los lugareños conocedores de la fauna, indican que C. c. rubicundus tiene una amplia distribución en la cuenca del Tapiche, siendo particularmente abundantes en el Río Blanco. Un informante indicó que la margen occidental del Blanco por falta de especies maderables ha permanecido intocada, consecuentemente allí abunda el huapo colorado. Además, Cacajao está presente también en otras áreas de la margen oriental del Río Ucayali y Amazonas en Loreto. Por ejemplo, Soini (comunicación personal) vio un grupo en la Quebrada Blanco, afluente del Río Tahuayo (Fig. 1); otro investigador me informó la presencia de la especie a varias millas al interior de los bosques de Jenaro Herrera (R. Castro, com. per.). Por consiguiente, el km de distribución de Cacajao en el Perú abarca los bosques inundables al Este de los Ríos Ucayali y .Amazonas en Loreto.
Los habitantes de la cuenca del Tapiche consideran más comunes al huapo rojo que Lagothrix y Ateles, pero menos común que algunos de los otros monos grandes, como Cebus, Alouatta y Pithecia.
U presión de caza juega un papel importante en la abundancia de los Cébidos grandes. Dos tipos de caza parecen prevalecer: caza realizada por los moradores y caza realizada por las cuadrillas de madereros. No hay forma de estimar el perjuicio causado por cada sector; los cazadores probablemente matan en proporción a su abundancia local; cazan por la carne y no por placer, y tienden a cazar lo más fácil de conseguir. Los campesinos del Tapiche opinan que Ateles y Lagothrix tienen la mejor carne, por ende son más amenazados que huapo rojo. En vista que la presión de caza probablemente es mayor que la producción neta de animales en la población, una moratoria en cuanto a la caza de Cacajao, Ateles y Lagothrix sería muy recomendable. Estos monos, debido a su baja tasa natural de crecimiento poblacional intrínseco, requieren una protección especial. La moratoria tendría que ser apoyada por un programa educacional y/o de publicidad, ya que el cumplimiento con esta medida tendría que ser mayormente voluntario. Sin embargo, debido a la amplia extensión de la cuenca del Tapiche, es obvio que sería casi imposible controlar una observancia estricta de la moratoria.
Los resultados del reconocimiento de la cuenca del Tapiche sugieren que esta región es pobre en monos. Es probable que la escasa fauna primatológica refleje en parte los bajos niveles poblacionales que generalmente caracterizan a las áreas de los ríos de aguas negras. Parece improbable que la escasa población humana del Tapiche y sus afluentes fueran del todo responsable de la poca abundancia de monos. Precisamente, las poblaciones escasas son las más vulnerables a un rápido agotamiento.
El huapo rojo es una de las pocas especies no protegidas dentro
del sistema de parques en la Amazonía Peruana; por lo tanto, en Loreto
se requiere una reserva para su protección. Por ejemplo, podría
ser como está indicado en la Fig. 1. Esta cuenca seria conveniente para
el establecimiento de la reserva por varias razones: 1) existe huapo colorado
en números relativamente grandes; 2) la población humana es muy
escasa; 3) según información recogida, áreas extensas de
buen hábitat para Cacajao carecen de especies maderables, y 4) el acceso
a la reserva puede ser controlado con solamente patrullar una sola área.
Tal vez algunos fondos para el establecimiento y/o mantenimiento de esta reserva
podrían venir de la División de Asuntos Internacionales de U.S.
Fish & Wildlife Service.
AGRADECIMIENTOS
Este estudio fue financiado por el Comité de Conservación de la Sociedad Zoológica de Nueva York. Personal de campo, además del autor, incluyó a Isabel Constable y Russell Mittermeir. Deseo agradecer especialmente a María y Pekka Soini, quienes me enseñaron castellano y primatología.
El personal del Proyecto Primates apoyó mucho este estudio. Las siguientes personas proporcionaron valiosa ayuda y estímulo: Dr. Rogerio Castro, Ing. Ramón Ruíz Hidalgo, Dr. Carlos Málaga y Prof. Dr. Hernando de Macedo-Ruíz.
REFERENCIAS
Fontaine, R. 1981. The Uakaris, Genus Cacajao. pp.
443-493. En A.F. Coimbra-Filho y R.A. Mittermeier (Eds.). Ecology and
Behavior of Neotropical Primates. Vol. 1. Academia Brasileira de Ciencias,
Río de Janeiro.
Fontaine, R. y F.V. Dumond. 1977. The red uakari in a seminatural environment:
potentials for propagation and study. pp. 167 - 236. En G.H. Bourne y
H.R.N. Prince Rainer (Eds.). Primate Conservation Academic Press,
New York.
Williams, L. 1936. Woods of Northeastern Peru. Botanical Series, Field
Museum of Nat. Hist, 15 (1977).
