

DESARROLLO DENTARIO Y LA ESTIMACIÓN DE LA EDAD EN Cebuella pyginaea, Saguinus fuscicollis y Saguinus mystax
Pekka Soini y María de Soini
INTRODUCCIÓN
Para el estudio de la estructura o dinámica poblacional de una población de primates es indispensable el poder determinar la edad aproximada de los animales, o por lo menos establecer criterios confiables para la clasificación de los integrantes de la población en categorías definidas de edad.
Estudios realizados sobre el patrón temporal del desarrollo de los dientes en los Callitrícidos (Chase y Cooper 1969, Johnston et al. 1970, Winter 1978, Glassman 1983) han indicado la gran utilidad de la cronología de erupción de los dientes para la determinación de la edad de estos animales. Sin embargo, estos estudios, así como los craneológicos sobre las secuencias de emergencia o erupción alveolar (Debemos señalar aquí que la secuencia de erupción de los dientes a través de la gingiva no siempre concuerda con la secuencia de la erupción alveolar, por lo que las dos secuencias no son estrictamente comparables, como ya lo indicó Hershkovitz (1977: 317), de los dientes de esta familia (Della Serra 1952, Hershkovitz 1977, Byrd 1981), han mostrado la existencia de marcadas diferencias entre géneros en el patrón secuencial del desarrollo dentario. En cuanto a las diferencias existentes entre las especies de cada género muy poco se sabe.
De las 14 ó más especies actualmente reconocidas, se han realizado estudios de la cronología de erupción en sólo 3 especies: Callithrix jacchus (Johnston et al. 1970, Winter 1978), Saguinus nigricollis (Chase y Cooper 1969) y Saguinus fuscicollis (Glassman 1983). De éstos, sólo el estudio de Chase y Cooper (1969) sobre S. nigricollis y el de Winter (1978) sobre C. jacchus consistían en el seguimiento del desarrollo dentario en animales vivos. Los de Johnston et al. (1970) y Glassman (1983) consistían en el examen de la dentadura de una serie de animales muertos y preservados, de edad conocida, por lo que los datos obtenidos por ellos sobre la cronología de erupción son menos precisos que los datos obtenidos en los antedichos estudios.
En el presente informe se reportan los resultados de un estudio a largo plazo sobre el desarrollo dentario de Cebuella pygmaea, Saguinus fuscicollis y Saguinus mystax realizado como parte de una investigación más amplia, iniciada en 1976 y continuada hasta 1982, sobre el desarrollo ontogénico de las 3 especies. Los otros aspectos del desarrollo físico serán materia de un informe posterior.
MATERIALES Y MÉTODOS
La investigación del desarrollo dentario fue enfocada principalmente en la secuencia y cronología de erupción de los dientes permanentes y en el crecimiento subsiguiente de los caninos. La cronología de los dientes de leche fue investigada menos intensivamente.
El material principal de estudio consistió en 11 ejemplares de C. pygmaea, 8 ejemplares de S. fuscicollis y 3 ejemplares de S. mystax, los que fueron criados por nosotros en cautiverio y examinados periódicamente. Con la excepción de 5 C. pygmaea nacidos en el transcurso del estudio, estos animales fueron capturados como infantes de poblaciones naturales y sus fechas exactas de nacimiento eran desconocidas. El Cuadro 1 especifica el origen y período de estudio de cada uno de ellos. Datos adicionales sobre la cronología de erupción de los dientes fueron obtenidos de 6 infantes de C. pygmaea, 12 de S. fuscicollis y 21 de S. mystax, todos ellos de edad conocida, cuyo desarrollo dentario fue seguido por períodos breves (por un mes o menos), o examinado una sola vez. Además de estos animales, se examinaron 38 infantes y juveniles silvestres de C. pygmaea, 26 de S. fuscicollis y 58 de S. mystax con la dentadura en pleno proceso de erupción, los que nos proporcionaron información adicional sobre las secuencias de erupción dentaria.
La crianza y seguimiento sostenido del desarrollo dentario de los Saguinus fueron iniciados en Río Tapiche en junio de 1978 y luego continuados en Iquitos hasta julio 1979; los de los C. pygmaea fueron iniciados en Río Manití en Enero 1979, continuados en Iquitos y luego en la Estación Biológica de Cahuana, Río Pacaya hasta junio 1982.
Para que el desarrollo ontogénico de los animales sea lo más natural posible, se les trató de proporcionar un medio ambiente y alimentación parecidos en lo posible al estado natural. Fueron mantenidos en grupos familiares, cada especie separada una de la otra, en jaulas de 110 x 85 x 50 cm, colocados al aire libre, bajo un árbol o dentro de vegetación natural (en Iquitos en el jardín de la casa). Cada jaula contenía 1 ó 2 cajas de dormir y varias perchas; con acceso a la sombra y a menudo también a la luz directa del sol. En los días de fuertes lluvias y en las noches las jaulas eran cubiertas con techado impermeable. Para incrementar aún más la naturalidad del ambiente, se colocó frecuentemente en el interior de las jaulas, ramas con follaje (con o sin frutos).
La dieta consistía principalmente en insectos vivos (ortópteros, odonatos, coleópteros, hemípteros y lepidópteros), pequeñas lagartijas (mayoritariamente Anolis spp., Conatodes humeralis y Hemidacty1us mabouya), pequeños peces, frutos silvestres (Cecropia spp., Couma spp., Ficus spp., Inga spp., Manilkara sp., Kysalis sp., Pourouma spp., Rheedia spp., Spondias mombin, etc.), frutos cultivados localmente (bananas, papayas, mangos, anonas, pomarrosas, guavas, guayabas, caimitos, uvillas, etc.), y exudado solidificado de algunas especies de árboles y lianas (Inga spp., Acacia spp., Gnetum sp., Bauhinia sp. y Vochysia lomatophylla). A veces se les ofrecía también arroz cocido, yuca cocida, pan , pescado y carne cocida. Esta dicta fue suplementada particularmente al inicio, con papilla de cereales mixtos 'T-4estum" y con "Sustagen" para asegurar una ingestión adecuada de vitaminas y minerales. El alimento era suministrado básicamente 2 veces al día, pero generalmente recibían insectos de nuestras manos a lo largo de todo el día. Agua tenían disponible durante todo el día.
Exceptuando alguna diarrea ocasional, los animales se mantenían bien de salud; no se observaron pérdidas de pelo alrededor de los ojos ("anillos oculares"), que a menudo se observan en las colonias de laboratorio de Callitrícidos, mas no en las poblaciones naturales.
Para el seguimiento de la erupción de los dientes permanentes, los animales fueron examinados por intervalos regulares de 5 días, desde el inicio del estudio hasta que todos los dientes habían erupcionado, luego por intervalos de 10 días hasta que los caninos ya no mostraban crecimiento perceptible. El seguimiento de la erupción de los dientes de leche fue menos regular, ajustándose más bien a la cronología anticipada que a un protocolo fijo.
El criterio de erupción fue el mismo aplicado por Chase y Cooper (1969); el diente fue considerado erupcionado cuando toda su corona había penetrado a través de la gingiva; y cuando el diente de un lado de la mandíbula erupcionó antes de su contraparte del lado opuesto; la erupción de este último fue considerada la fecha de erupción. La medida del crecimiento de los caninos fue la longitud del canino, medida desde el borde superior de la gingiva a la punta del canino. En vista que los caninos maxilares tendían a alcanzar un tamaño ligeramente mayor y tomar más tiempo para completar su crecimiento que los caninos mandibulares, el seguimiento fue enfocado en el crecimiento de los primeros. Para la medición de los caninos se utilizó un vernier de joyero.
Al reportar sus resultados, Chase y Cooper (1969) y Classman
(1983) emplearon la semana como unidad de tiempo. No obstante, para la cronología
de erupción de los dientes de lecho, nosotros optamos por emplear el
día y para la erupción de los dientes permanentes el mes (30 días)
y décimos del mes como unidades de tiempo, por ser éstas más
convenientes y menos ambiguas. Al comparar sus resultados con los nuestros,
también los datos cronológicos de ellos fueron convertidos en
meses y décimos de meses. La nomenclatura y sistema de anotación
de los dientes empleados están indicados en Cuadro 2.
RESULTADOS Y DISCUSIÓN
Cebuella pygmaea
Erupción de los dientes de leche.
La secuencia y cronología de erupción de los dientes de leche fueron verificadas mediante el seguimiento del desarrollo dentario en las 5 crías nacidas en cautividad (Cuadro l), de las cuales dos (Mamerto y Mafalda) fueron examinadas por intervalos regulares de 3 días y las otras 3 (Tatín, Russ e Isabel), periódicamente. Datos adicionales fueron obtenidos de 6 crías de origen silvestre, pero con fechas de nacimiento conocidas.
En ambas mandíbulas, la erupción sigue una secuencia ordenada desde adelante hacia atrás. Nacen sin dientes erupcionados o con los primeros incisivos ya erupcionándose. Los 11, que son los primeros en emerger a través de la gingiva, erupcionan en el transcurso del primer día de vida y la erupción de todos los incisivos se concluye en la segunda semana de vida. La erupción de los dientes de leche es concluida a los 1,0 - 1,4 meses de edad (Cuadro 3).
Erupción de los dientes permanentes. La erupción de los dientes permanentes fue seguida en los 6 animales de origen silvestre (Cuadro 1) y en un animal nacido en la cautividad (Tatín), que fue examinado con menor regularidad que los 6. Al comenzar el seguimiento, los de origen silvestre tenían todos los dientes de leche erupcionados, pero todavía ningún permanente y sus edades estimadas variaban entre 1 1/2 y 2 1/2 meses (Cuadro l). Exámenes esporádicos de los otros 4 animales nacidos en cautividad proporcionaron información adicional sobre la cronología de erupción.
Cuadro 1.- Datos de los principales animales
utilizados para el seguimiento del desarrollo dentario.
|
Nombre |
Sexo |
Fecha de nac. o(mes estirnado) |
Origen |
Edad (meses) |
|
| Cebuella pygmaea | al comienzo al término | del estudio | |||
| Marquito* | M | (Nov. 78) | Salvaje (R.Maniti) | 2 1/2 | 43 |
| Waldo* | M | " | " | 2 1/2 | 21 |
| Thelma | H | (Nov. 78) | Salvaje (R.Maniti) | 2 1/2 | 43 |
| Carmelo* | M | (Dic. 78) | " | 1 1/2 | 42 |
| Carolina* | H | " | " | 1 1/2 | 42 |
| Taymi | M | (Dic. 78) | " | 2 | 38 |
| Tatín | M | 17.09.80 | Cría de Taymi y Waldo | 0 | 20 |
| Rus:? | M | 25.11.80 | Cría de Carolina y Marquito | 0 | 18 |
| Isabel* | H | " | 0 | 18 | |
| Marnertó* | M | 03.05.81 | Cría de Carolina y Marquito | 0 | 13 |
| Mafalda* | H | " | " | 0 | 13 |
| Saguinus fuscicollis | |||||
| Manuela | H | (Mar. 78) | Salvaje (R.Tapiche) | 3 1/2 | 16 |
| Dalico | M | (Mar. 78) | " | 5 | 17 |
| Margarita | H | (Mar. 78) | " | 4 | 15 |
| Gerardo* | M | (Abr. 78) | " | 3 1/2 | 5 |
| Mechita* | H | " | " | 3 1/2 | 13 |
| Chony* | H | (May. 78) | " | 4 1/2 | 14 |
| Neneca* | H | " | " | 4 1/2 | 14 |
| Eleonora | H | (May. 78) | " | 5 | 14 |
| Saguinus mystax | |||||
| Memo* | M | (Feb. 78) | " | 4 1/2 | 18 |
| Candy* | H | " | " | 4 1/2 | 18 |
| Blondy | H | (Abr. 78) | " | 2 1/2 | 16 |
M = macho; H = hembra
* Infantes procedentes
de la misma camada.
Cuadro 2.- Terminologías y anotaciones
empleadas en la enumeración de los dientes en Callitrícidos
| Maxilar o superir | Mandibular o Inferior | ||
| Primer incisivo | I1 | I1 | I1 |
| Segúndo incisivo | I2 | I2 | I2 |
| Canino | C | C1 | C1 |
| Primer premolar | P1 | P1 | P1 |
| Segúndo premolar | P2 | P2 | P2 |
| tercer premolar | P3 | P3 | P3 |
| Primer molar | M1 | M1 | M1 |
| Segúndo molar | M2 | M2 | M2 |
Cuadro 3 .- La cronología de erupción de los dientes de leche
observada en Cebuella pygmaea
| Día de nacido | (N) | |
| I1 | 1 | (3) |
| I1 | 3-5 | (3) |
| I2 | 9-10 | (2) |
| I2 | 10-11 | (2) |
| C1 | 17-18 | (2) |
| C1 | 20-22 | (2) |
| P1 | 25-30 | (3) |
| P2 | 26-30 | (3) |
| P3 | 31-42 | (4) |
La secuencia de erupción de los dientes permanentes fue
la siguiente:
| Maxila |
: MI - Il -M2-(p3-p2)-(pl-12)-Cl |
|
| Mandíbula |
: MI - 11 - M2 - 12-P3 - P2 - PI - CI |
|
El cambio de los dientes de leche por permanentes fue siempre iniciador, en ambas mandíbulas, por los I1, precedido por la erupción de los M1, pero nunca por la erupción de los M2. No obstante, en 2 juveniles silvestres examinados los M2 habían erupcionado antes de los I1. Los P2 y P3 erupcionaron simultáneamente o casi simultáneamente; y los 12 erupcionaron antes de los P1 en 3 animales, y después de los P1 en 3 animales. En cuatro juveniles silvestres examinados los I2 precedieron en uno y los P1 en 3 animales. El desarrollo tardío de los I2 en relación a los otros dientes se observa únicamente en Cebuella entre los Callitrícidos y los primates en general (Byrd 1981). La secuencia de erupción de los dientes mandibulares fue uniforme en todos los animales; tampoco se observaron divergencias de esta secuencia en los juveniles silvestres examinados, excepto en los dos casos ya mencionados.
Los dientes mandibulares M1, M2, -I2 Y C1 erupcionaron siempre antes de sus contrapartes maxilares y los P1, Y P2 después de sus contrapartes maxilares; los I1 y P3 erupcionaron aproximadamente simultáneamente en ambas mandíbulas.
La duración del período total de erupción de los dientes permanentes, desde la erupción de los M1, hasta la de los C1, para ocho animales fue de 5,2 a 6,2 meses, con un promedio de 5,6 meses. En dos animales con fechas exactas de nacimiento, la erupción de los dientes permanentes fue concluida a los 8,7 y 8,8 meses de edad, respectivamente.
Cuadro 4.- La secuencia temporal de erupción
de los dientes permanentes en relación a la fecha de erupción
de los M, en 6 Cebuella pygmaea de origen silvestre, expresada en meses.
| X | Rango | |
| M1 | - | - |
| M1 | 0,2 | (0,2 - 0,3)* |
| I1 | 2,2 | (1,8-2,7) |
| I1 | 2,2 | (2,0-2,3) |
| M2 | 2,8 | (23-3,2) |
| M2 | 3,0 | (2,5-3,5) |
| I1 | 3,4 | (3,0-3,8) |
| P3 | 3,7 | (3,3-4,3) |
| P3 | 3,8 | (3,5-4,3) |
| P2 | 3,9 | (3,5-4,3) |
| P2 | 4,5 | (3,8-4,8) |
| I2 | 4,5 | (4,2-5,2) |
| P1 | 4,6 | (4,3-5,2) |
| P1 | 4,8 | (4,3-5,3) |
| C1 | 5,1 | (4,7-5,7) |
| C1 | 5,5 | (5,2-5,8) |
* Los datos de M1 están basados en los cinco animales nacidos
en cautividad.
El Cuadro 4 muestra la secuencia temporal de erupción de los dientes en relación a la fecha de erupción del primer par de dientes permanentes (los M1) en los 6 animales de origen silvestre. Las diferencias interindividuales o rangos observados son relativamente pequeños, no pasando de 1,0 mes para ningún diente, lo que nos sugiere que la cronología de erupción es marcadamente constante en la especie.
En los 5 animales nacidos en cautividad, los primeros dientes permanentes (los M1) erupcionaron a los 2,9 - 3,3 (X = 3,1) meses de edad y los M1 a los 3,1 - 3,5 (X = 3,3) meses. En base a los datos presentados en el Cuadro 4 y la edad promedio de erupción del primer par de dientes permanentes (3,1 meses), podemos estimar la cronología de erupción de todos los dientes permanentes en C. pygmaea. El Cuadro 5 presenta la cronología resultante. Comparación de esta cronología con los datos disponibles sobre la cronología de erupción en un macho de fecha de nacimiento conocida (Tatín) muestra una gran concordancia entre las dos series de datos (Cuadro 5).
En conclusión, en C. pygmaea la erupción de los dientes permanentes se inicia al final del tercer o comienzo del cuarto mes de vida, el cambio de los dientes de leche por permanentes a mediados del sexto mes y la erupción de los dientes permanentes se concluye a mediados o hacia finales del noveno mes de vida.
Cuadro 5.- A) Cronología estimada de
erupción de los dientes permanentes en Cebuella pygmaea. B)
Cronología de erupción observada en 1 macho nacido en cautividad.
| I1 | I2 | C | P1 | P2 | P3 | M1 | M2 | |
| A)* | ||||||||
| Maxilar: | 5,3 | 7,6 | 8,6 | 7,7 | 7,0 | 6,8 | 3,3 | 6,1 |
| Mandíbula: | 5,3 | 6,5 | 8,2 | 7,9 | 7,6 | 6,9 | 3,1 | 5,9 |
| B)* * | ||||||||
| Maxilar: | 5,5 | 65-8,0 | 8,7 | 65-8,0 | 65-8,0 | 65-8,0 | 3,2 | 5,5-6,5 |
| Mandíbula: | 5,5-6,5 | 6,5-8,0 | 8,1 | 6,5-8,0 | 6,5-8,0 | 6,5-8,0 | 2,9 | 5,5-6,5 |
* Edad promedio en meses.
* Edad absoluta en meses o, cuando la fecha exacta de erupción
no fue constatada, el intervalo de edad.
Crecimiento de los caninos. El seguimiento del crecimiento de los caninos maxilares en los 6 animales de origen silvestre y en uno nacido en cautividad (Tatín), indicó que éstos alcanzan la longitud de 2,5 mm a los 9-11 meses de edad. El mínimo tamaño de caninos intactos observado comúnmente en los dos adultos salvajes es de 2,7 mm. Esta longitud fue alcanzada a los 11-13 meses; luego siguieron creciendo muy lentamente, hasta alcanzar el tamaño de 2,9-3,0 mm a los 15-17 meses de edad. Las observaciones de este estudio sugieren que el desarrollo de los caninos tiende a ser algo más retardado en las hembras que en los machos. Sin embargo, esto requiere verificación en base a una muestra más amplia.
El examen de los caninos de los animales de estudio a los 2 1/2 años de edad reveló que las puntas de éstos ya presentaban un ligero pero claramente perceptible desgaste en todos menos uno de los animales. Esto nos indica un límite general de edad de 2 -2 1/2 años para los adultos con caninos sin desgaste.
Saguinus fuscicollis
Erupción de los dientes de leche. La secuencia y cronología de erupción de los dientes de leche fueron observadas en un macho y una hembra desde el nacimiento hasta 24 días de edad, y en 7 animales adicionales desde el nacimiento hasta 2 días de edad. Todos tenían los 11, 12 y C erupcionados al nacer algunos también los P1.La secuencia de erupción de los dientes restantes siguió ordenadamente desde adelante hacia atrás. El Cuadro 6 muestra la cronología observada. La edad de erupción de los P3 no fue verificada, pero en vista que la cronología observada para los otros dientes concuerda bien con las observaciones correspondientes de Glassman (1983) y Chase y Cooper (1969), podemos suponer, en base a sus datos, que éstos erupcionan normalmente en el transcurso del segundo mes de vida.
Erupción de los dientes permanentes. La secuencia de erupción
de los dientes permanentes observada en los 7 animales de seguimiento sostenido
(Cuadro 1) fue la siguiente:
| Maxila : |
MI - 11 - 12 - (M2 - p3)_p2 - pl - CI |
|
| Mandíbula : |
MI -11 -12-M2-P3- Pl -P2-CI |
|
En 3 animales, los M2 precedieron a los P3 en otros 3 el orden fue inverso, y en uno erupcionaron simultáneamente. En ambas mandíbulas los 12 erupcionaron siempre antes de los M2, y el examen de varios juveniles silvestres tampoco reveló desvíos de esta secuencia.
Los I2. P1 M1 Y M2 erupcionaron siempre antes de sus contrapartes maxilares, mientras que los P2, P3 y C1, erupcionaron siempre después de sus contrapartes maxilares; los I1 erupcionaron aproximadamente simultáneamente en ambas mandíbulas.
La secuencia de erupción de los dientes maxilares observada en este estudio difiere de la secuencia dada por Glassman (1983) en el sentido que, en nuestros animales de estudio y en los juveniles silvestres examinados, los P2 erupcionaron siempre antes de los P1, coincidiendo en este respecto con lo observado por Chase y Cooper (1969) en S. nigricollis y por nosotros en S. mystax (vea más adelante). Además, el hecho que ésta sea la secuencia de erupción también en los otros Callitrícidos estudiados (Callithrix jacchus, Johnston et al. 1970, Winter 1978, y Cebuella pygmaea, este estudio), parece indicar que es una característica común de todos los Callitrícidos. La secuencia inversa (p1-p2) encontrada por Glassman (1983) fue, por lo tanto, probablemente basada en un caso aberrante.
En contraste con las observaciones de los otros estudios sobre secuencias de erupción de los dientes en Callitrícidos, en nuestros animales de estudio los caninos maxilares erupcionaron antes de los caninos mandibulares en 5 animales y simultáneamente con éstos en los 2 animales restantes. Asimismo, en 4 animales silvestres con los caninos en plena erupción, 2 tenían sólo los 0 erupcionados y 2 tenían ambos pares emergiendo simultáneamente, corroborando así la observación de que en S. fuscicollis, los CI tienden a erupcionar antes de los C,. Esta fue la secuencia observada también en S. mystax.
Para el seguimiento de la cronología de erupción contamos con 6 infantes de origen silvestre y uno nacido en cautividad. De los 6 primeros, 3 (Manuela, Mechita y Gerardo) tenían la dentadura de leche completa, pero ningún diente permanente erupcionado y 3 (Margarita, Chony y Neneca) tenían los primeros dientes permanentes (los M1) ya erupcionados al comenzar el seguimiento. Los 2 infantes restantes (Dalico y Eleonora) ya tenían los M1 e 11 erupcionados al comenzar el estudio, por lo que no fueron incluidos en este análisis. Por lo tanto, el desarrollo dentario de los 3 primeros fue seguido a partir de la erupción de los primeros dientes permanentes, los M, y de los otros 3 a partir de la erupción del siguiente par de dientes, los 11. El Cuadro 7 muestra la secuencia temporal de erupción de sus dientes en relación a la fecha de erupción de los Mi en los primeros tres animales y en relación a la de 11 en los otros tres.
Cuadro 7.- La secuencia temporal de erupción de los dientes permanentes en relación a la fecha de erupción de: (A) los M, (m3)* y (B) los 1, (n=3) en Saguinus Mcicollis de origen silvestre, expresada en meses
| (A) | X | (rango) | (B) | X | (rango) |
| M1 | - | - | |||
| M1 | 0,2 | (0,2-0,3) | |||
| I1 | 0,9 | (0,7-1,2) | I1 | - | - |
| I1 | 0,9 | (0,7-1,2) | I1 | - | - |
| M2 | 1,5 | (1,2-1,7) | M2 | 0,7 | (0,7-1,2) |
| M2 | 1,5 | (1,2-1,8) | M2 | 1,1 | (1,0-1,2) |
| I1 | 2,2 | (2,0-2,3) | I1 | 1,9 | (1,7-2,2) |
| P3 | 2,7 | (2,3-3,0) | P3 | 2,2 | (2,0-2,3) |
| P3 | 7,7 | (2,3-3,2) | P3 | 2,5 | (2,2 - 2,8) |
| P2 | 2,9 | (2,5-3,2) | P2 | 2,5 | (2,3-2,7) |
Las variaciones interindividuales o rangos observados en este estudio son notablemente pequeños, sólo unas 2 semanas en término medio, para cada tipo de diente (Cuadro 7). Esto sugiere que la cronología de erupción es bastante uniforme en S. fuscicollis. Sólo en los casos de P2 y Cl se observaron rangos de 1 mes y hasta un poco más. Cabe notar que también en el estudio de Chase y Cooper (1969) los P, reportaron la mayor amplitud de variación interindividual.
En el único animal con la fecha de nacimiento conocida, los M, erupcionaron a los 3,7 meses de edad y los M1
a los 3,9 meses. Los 11 de ambas mandíbulas erupcionaron a los 4,6 meses. También los datos de Chase y Cooper (1969) y Glassman (1983)* indican 3,7 meses como la edad promedio para la erupción de los M, Igualmente, la edad de erupción de los primeros incisivos (l,) fue 4,6 meses en el estudio de Chase y Cooper, mientras que los datos de Glassman indican 4,9 meses. Considerando 3,7 meses como la edad promedio para la erupción de los M, y 4,6 meses para la de los M1 podemos estimar la cronología de erupción de todos los dientes en base a los datos presentados en el Cuadro 7. El Cuadro 8 muestra la cronología resultante y compara ésta con las de Glassman (1983); debido a la naturaleza del material disponible para su estudio, sólo estima rangos de edad (en semanas) para la erupción de cada tipo de diente. Debido al criterio empleado (Glassman 1983: 53), el extremo mayor de cada rango tiende a sobrestimar el verdadero rango de edad, mientras que el extremo menor se aproxima más al valor promedio de edad, por lo que es tomado aquí como la edad representativa de erupción.y Chase y Cooper (1969). Los resultados de los tres estudios muestran una marcada concordancia. La única divergencia mayor es la edad más tardía dada por Glassman para la erupción de los P2, lo que ya fue comentado al tratar sobre la secuencia de erupción.
En conclusión, en S. fuscicollis la erupción de los dientes permanentes se inicia hacia el final del cuarto mes de vida, el cambio de los dientes de leche por permanentes a mediados o hacia el final del quinto mes y la erupción de los dientes concluye a los 9 meses de edad.
Crecimiento de los caninos. El crecimiento de los caninos fue seguido en 7 animales (Cuadro D. El incremento de la longitud de los caninos maxilares fue relativamente uniforme en todos los animales a través del primer mes de erupcionados. En el segundo mes, aproximadamente a partir de 3,5 mm de longitud, la velocidad del crecimiento mostraba una mayor variación individual (Cuadro 9). El crecimiento perceptible fue concluido en 4-5 meses (X = 4,4 meses, Cuadro 9). Considerando 8,7 meses como la edad promedio para la erupción de los caninos maxilares en S. fuscicollis, y tomando en cuenta la variación interindividual observada en la cronología de erupción (Cuadro 7) y crecimiento (Cuadro 9) de los mismos, podemos concluir que el crecimiento de los caninos es concluido normalmente a los 13 + 1 meses de edad.
Cuadro 8 .- Cronología estimada de erupción
de los dientes permanentes en Saguinus fuscicollis y comparación
con las cronologías de erupción presentadas por Classman (1983)
y Chase y Cooper (1969)*.
| . | I1 | I2 | C | P1 | P2 | P3 | M1 | M2 |
|
Dientes maxilares |
||||||||
| Presente estudio |
4,6 |
5,5 |
8,7 |
7,4 |
7,2 |
6,7 |
3,9 |
6,8 |
| Classman (1983) |
4,9 |
5,4 |
9,1 |
7,5 |
8,9 |
6,8 |
4,2 |
6,8 |
| Chase y Cooper (1969) |
4,9 |
6,1 |
9,3 |
7,6 |
7,1 |
6,7 |
4,0 |
6,5 |
|
Dientes mandibulares |
||||||||
| Presente estudio |
4,6 |
5,2 |
9,0 |
7,2 |
7,5 |
6,9 |
3,7 |
6,2 |
| Glassman (1983) |
4,9- |
5,4 |
9,1 |
7,5 |
8,6 |
6,8 |
3,7 |
6,8 |
| Chase y Cooper(1969) |
4,6 |
5,2 |
9,2 |
7,3 |
7,8 |
6,7 |
3,7 |
6,0 |
* Las cifras indican las edades promedio (expresadas en meses), excepto en el caso de los datos de Glassman, donde el extremo menor del rango ha sido tomado como valor representativo de la edad de erupción (ver nota al pie de pág. 264).
Cuadro 9 .- Relación aproximada entre
la longitud de los caninos maxilares y la edad en Saguínus fuscicollis.
| Longitud del canino |
|
| 2,0 mm |
|
| 2,5 mm |
|
| 3,0 mm |
|
| 3,5 mm |
|
| 4,0 mm |
|
| 4,5 mm |
|
| 5,0 mm |
|
Glassman (1983) no examinó el crecimiento de los caninos y Chase y Cooper
(1969) no reportaron detalles sobre el particular, pero observaron que éstos
alcanzaron su tamaño completo a los 11 ó 12 meses de edad.
Saguinus mystax
Erupción de los dientes de leche. La secuencia y cronología de erupción de los dientes de leche fueron estudiadas mediante examen de 14 infantes de edad conocida. Además, se examinaron 12 infantes silvestres con la dentadura de leche todavía incompleta, de edad exacta desconocida.
Como en los otros Callitrícidos, la secuencia de erupción procede, en ambas mandíbulas, desde adelante para atrás. Los 3 infantes examinados el primer día de nacidos tenían los incisivos mandibulares erupcionados; uno de ellos tenía también los maxilares erupcionados. A los 2 días de edad, todos los incisivos ya están erupcionados (n = 4). Los caninos mandibulares empiezan a penetrar la gingiva a los 2-4 días (n= 4) y erupcionan a partir de 5 días de edad. Los caninos maxilares y los primeros premolares erupcionan en la segunda semana de vida, los P2 a mediados o finales del primer mes y los P3 hacia finales del segundo mes (Cuadro 10).
Erupción de los dientes permanentes. La secuencia y cronología
de erupción de los dientes permanentes fueron seguidas sostenidamente
en 3 animales (Memo, Candy y Blondy) que, al comenzar el seguimiento, tenían
todos los dientes de leche erupcionados pero todavía ningún permanente.
Datos adicionales fueron proporcionados por 7 animales de edad conocida, observados
por períodos breves o examinados una sola vez. La secuencia de erupción
fue la siguiente :
Maxila M1 - I1 - I2- M2-p3-p2-p1-C1
Mandíbula M1 - I1 - (I2- M2) -P 3 - P1 - P2 - C1
Cuadro 10.- Cronología de erupción de los dientes de leche observada en Sanguinus mystax.
| Día de nacido | (N) | |
| I1 | 1 - 2 | (6) |
| I2 | 1 - 4 | (9) |
| C1 | 5 | (1) |
| C1 | >6<16 | (2) |
| P1 | >6<16 | (2) |
| P2 | 16 - 30 | (3) |
| P3 | >50<60 | (1) |
En 2 animales los I2 erupcionaron 0,7 meses antes de los M2 y en un animal ambos erupcionaron simultáneamente. El examen de 46 juveniles silvestres
con la dentadura permanente en pleno proceso de erupción no reportó divergencias de las secuencias indicadas. Los P' ' p2 y Cl erupcionaron antes de sus contrapartes mandibulares y 105 M2 después de éstos; los Il, 12, P3 y M1 erupcionaron aproximadamente simultáneamente en ambas mandíbulas.
El Cuadro 11 muestra los resultados de] seguimiento de la cronología de erupción de los dientes en relación a la fecha de erupción de los primeros dientes permanentes (los MI) en los 3 animales. La fluctuación interindividual observada fue menor de un mes para cada tipo de diente, siendo en general mayor para los premolares que los otros dientes (Cuadro 11).
En 3 animales de edad conocida, los MI erupcionaron a los 4,3 - 4,7 (X = 4,5) meses de edad. Basándonos en los datos presentados en el Cuadro 11 y considerando 4,5 meses como la edad promedio para la erupción de los MI, podemos estimar la cronología de erupción de los dientes en S. mystax. El Cuadro 12 presenta la cronología resultante. En conclusión, la erupción de los dientes permanentes se concluye a los 11 meses de edad.
Crecimiento de los caninos. En los S. mystax silvestres, los caninos maxilares alcanzan generalmente una longitud máxima de 6,0 - 6,5 mm, medida desde el borde superior de la gingiva a la punta del canino. El seguimiento del crecimiento de los caninos en los tres animales de referencia indicó que
Cuadro 11 .- Secuencia temporal de erupción
de los dientes permanente- en relación a la fecha de erupción
de los MI en 3 ejemplares de Saguinus mystax de origen silvestre, expresada
en meses.
|
|
X |
(rango) |
| M1 | - | - |
| M1 | 0 | 0 |
| I1 | 1,2 | (0,8-1,5) |
| I1 | 1,3 | (1,0-1,5) |
| M2 | 2,4 | (2,2-2,8) |
| M2 | 2,6 | (2,5-2,7) |
| I1 | 2,9 | (2,8-3,0) |
| P3 | 3,4 | (3,0-3,8) |
| P3 | 4,1 | (3,8-4,3) |
| P2 | 4,2 | (3,8-4,7) |
| P2 | 4,3 | (4,2-4,7) |
| I2 | 4,7 | (4,3-5,2) |
| P1 | 4,9 | (4,5-5,2) |
| P1 | 5,2 | (4,7-5,5) |
| C1 | 6,2 | (6,0-6,5) |
| C1 | 6,9 | (6,7-7,2) |
Cuadro 14 .- Comparación sináptica de los patrones temporales
del desarrollo dentario en 5 especies d. Callitrícidos y Saimiri sciureus.
Las edades o intervalos de tiempo son valores promedios presentados por los
respectivos autores, o calculados a base de esos valores, y expresados en meses.
Las especies están colocadas en orden ascendente de tamaño; los
pesos son valores promedios de adultos silvestres, excepto los de C. jacchus
y S. nigricollis, que fueron tomados de Hershkovitz 0Q77), y de S. sciureus,
tomado de Long y Cooper (1968).
| Cebuella pygmaea 110 g |
Callithrix jacchus 300 g |
Saguinus fuscicollis 330 g |
Saguinus nigricollis 478 g |
Saguinus mystax 515 g |
Saimiri sciureus ca. 900g (rango) |
|
|
Dientes de leche presentes en el |
I1 |
(I1) |
I1,I2,C,(P1) |
I1,I2,C,(P1) |
I1(I!,I2(I3) |
I1 |
|
Conclusión de la erupción de los |
1,2 |
1,2 |
1,4 |
1,8 |
1,9 |
2,1 |
|
Erupción de primeros dientes |
3,1 |
4,4 |
3,7 |
3,7 |
4,5 |
5,1 |
|
Inicio del cambio de dientes: |
5,3 |
6,3 |
4,6 |
4,6 |
5,7 |
9,2 |
|
Conclusión de la erupción de los |
8,6 |
10,3 |
9,0 |
9,3 |
11,4 |
21,5 |
éstos alcanzan los 6 mm de longitud a los 16-17 meses de edad y concluyen su crecimiento perceptible aproximadamente a los 18 meses de edad. El Cuadro 13 presenta la correlación aproximada entre la longitud de los caninos maxilares y la edad, según lo observado en este estudio.
Comparación entre especies
El Cuadro 14 compara los patrones temporales del desarrollo dentario de las5 especies de Callitrícidos que han sido estudiadas hasta ahora y del Cébido más pequeño, Saimiri sciureus. Exceptuando los datos disponibles de Callithrix jacchus, la edad en que se inicia y la edad en que concluye la erupción de los dientes permanentes avanzan con el tamaño de la especie. También el intervalo total de tiempo de dentadura mixta es notablemente más largo en el mayor de los Callitrícidos (S. mystax) que en los otros. También, el desarrollo de la dentadura de leche muestra diferencias filogenéticas y/o dependientes del tamaño, mientras que el intervalo de tiempo entre la con
clusión, de la erupción de los dientes de leche y el inicio de la erupción de.los dientes permanentes, parece ser más uniforme a través de la gama de especies y tamaños. La comparación con Saimiri demuestra que el desarrollo dentario es notablemente más acelerado en los Callitrícidos que en la especie representativa de los Cébidos pequeños.
Cuadro 12 .- Cronología estimada de erupción de los dientes permanentes en Sanguinus mystax
| I1 | I2 | C | P1 | P2 | P3 | M1 | M2 | |
| Dientes maxilares : | 5,7 | 7,0 | 10,7 | 9,2 | 8,8 | 8,7 | 4,5 | 7,9 |
| Dientes mandibulares: | 5,8 | 6,9 | 11,4 | 9,4 | 9,7 | 8,5 | 4,5 | 7,4 |
* Edad promedio de erupción en meses.
Cuadro 13 .- Relación aproximada entre
la longitud de los caninos maxilares y la edad en Saguinus mystax.
| Longitud del canino |
|
| 2,0 mm |
|
| 2,5 mm |
|
| 3,0 mm |
|
| 3,5 mm |
|
| 4,0 mm |
|
| 4,5 mm |
|
| 5,0 mm |
|
| 5,5 mm |
|
| 6,0 mm |
|
| 6,5 mm |
|
Los infantes utilizados para el seguimiento del desarrollo dentario en el presente estudio se criaron con sus madres hasta el segundo a quinto mes de vida (Cuadro l), y los infantes utilizados por Chase y Cooper (1969) hasta el cuarto mes de vida. En cambio, los infantes utilizados en el estudio por Winter (1978) de Callithrix jacchus fueron separados de sus madres a los 1-5 días de edad y criados a mano. El desarrollo relativamente tardío de la dentadura permanente en sus animales de estudio podría ser debido, por lo menos en parte, a un retraso anormal del desarrollo ontogénico de los infantes, causado por la crianza artificial de los mismos. Las muy amplias diferencias interindividuales observadas en su estudio, con los extremos inferiores de sus rangos de edad de erupción muy semejantes a los respectivos valores promedios de Cebuella por un lado, y de S. fuscicollis-nigricollis por otro lado, también sugiere que la falta de encajamiento de los datos disponibles de C. jacchus en el patrón general observado en el Cuadro 14, no sería una expresión de características filogenéticas.
REFERENCIAS
Byrd, K.E. 1981.
Sequences of dental ontogeny and Callitrichid taxonomy. Primates
22:103-118.
Chase, J.E. y R.W. Cooper. 1969. Saguinus nigricollis - Physical growth and
dental eruption in a small population of captive-born individuals. Am. 1. Phys.
Anthrop. 30: 111-116.
Della Serra, 0. 1952. A sequencia eruptiva dos dentes definitivos nos simios
Platyrrhini e sua interpretaçáo filogenética. (Publicación
privada), Sao Paulo, Brasil. 98pp-
Glassman, D.M. 1983. Growth and development in the saddle-back tamarin: The
sequence and timing of dental eruption and epiphysical union. Amer. 1. Primatol.
5: 51-59.
Hershkovitz, P. 1977. Living New World Monkeys (Platyrrhini). Vol. 1. Univ.
of Chicago Press, Chicago. xiv + 1117 pp. and Figs.
Johnston, G.W., S. Dreizen y B.M. Levy. 1970. Dental development in the cotton
ear marmoset
(Callithrix jacchus). Am. 1.Phys. Anthrop. 33: 41-48.
Long, J.0. y R.W. Cooper. 1968. Physical growth and dental eruption in captive-bred
squirrel monkeys, Saimiri sciureus (Leticia, Colombia). pp. 193-205.
En L.A. Rosenblum y R.W. Cooper (Eds.). The Squirrel Monkey. AcademicTress,
New York.Winter, M. 1978. Investigation on the sequence of tooth eruption in
hand reared Callithrix jacchus. pp. 109-124. En J. Rothe, H.J. Wolters
y J.P. Hearn (Eds.). Biology and Behavior of Marmoset. (Privately published),
Göttingen, Alemania.

DISTRIBUCION GEOGRAFICA Y ECOLOGIA
POBLACIONAL DE Saguinus mystax
Informe presentado al Ministerio de Agricultura en Octubre de 1982.
Pekka Soini y María de Soini
INTRODUCCION
Debido a su gran importancia en la investigación.biomédica y a la dificultad de su propagación en cautividad, el "pichico" Saguinus mystax constituye en la actualidad un recurso faunístico de gran valor e importancia para el país. A fin de adquirir conocimientos necesarios para un manejo adecuado de esta especie, estudios intensivos fueron iniciados en 1976, conjuntamente con la iniciación de la captura de ejemplares para el Centro de Reproducción y Conservación de Primates No Humanos de] Proyecto Peruano de Primatología. Los resultados preliminares de los primeros estudios realizados en la cuenca del Río Manití, con la participación de los biólogos R. Aquino, F. Encarnación, L. Moya y J. Tapia, fueron resumidos en un informe al Ministerio de Agricultura. Un segundo estudio de mayor importancia fue realizado por L. Moya y colaboradores en la cuenca del Río Yarapa en junio-Octubre 1978; los resultados de este estudio son presentados en este volumen (Moya el al., este volumen). Estudios posteriores, llevados a cabo en las cuencas de los Ríos Tahuayo y Tapiche en 1977-78 (Fig. 1) y los conocimientos que hemos adquirido sobre el desarrollo ontogénico de S. mystax nos permiten, en el presente reporte, reevaIuar los datos obtenidos en el primer estudio y analizar más ampliamente la ecología poblacional de la especie.
Los censos y estudios primatológicos que hemos realizado en los últimos años en la cuenca del Río Pacaya --dentro del programa de evaluación de la fauna de importancia económica de la Reserva Nacional Pacaya-Samiria- y en las de Tapiche, Ucayali, Amazonas y varios de sus afluentes, nos permiten delinear, en el presente informe, la distribución geográfica de S. Mystax en la Amazonía Peruana.
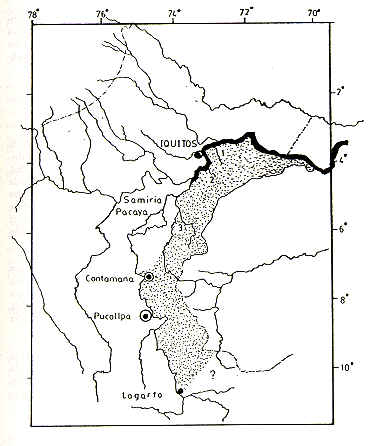
![]() Sanguinus mystax
Sanguinus mystax
Fig. 1.- Lugares de estudio : 1 Manití;
2 Tahuayo; 3 Tapiche
Mapa indicando los lugares de estudio y la distribución geográfica
de S. mystax en el Perú
METODOS
Los datos que sirvieron de base para el presente análisis provienen principalmente M examen de muestras capturadas de 3 poblaciones separadas de S. mystax y de las observaciones de campo hechas antes y durante las capturas. Los lugares y períodos de estudio y captura, y el número de individuos examinados en cada lugar fueron los siguientes:
- Cuenca del Río Manití, 10.09.76 - 28.02.77, 360 individuos.
- Cuenca del Río Tahuayo, 17.07.77 - 28.10.77, 91 individuos.
- Cuenca del Río Tapiche, 08.06.78 - 07.11.78, 165 individuos.
Además, examinamos varios neonatos nacidos durante o después de la captura. Para el análisis de la población del Manití, nos hemos valido principalmente de la muestra capturada en el área del Fundo Los Angeles (n= 186). No obstante, para algunos análisis más generales hemos considerado la citada muestra total de 360 individuos, que incluye los animales examinados por los otros biólogos que participaron en los estudios allí. Los métodos de captura y examen de los animales fueron los mismos empleados y descritos en el estudio de Saguinus fuscicollis (Soini, este volumen; ver también Encarnación et al., este volumen).
Para estimar densidades poblacionales de S. mystax, hicimos censos por transectos en varios lugares de la cuenca del Manití y en la Quebrada Blanco de la cuenca del Tahuayo. Para un censo más detallado, levantamos un mapa a escala 1:5000, de un área de 4 km2 de extensión, en Los Angeles (Río Manití), y graficamos en él todas las manadas y asociaciones sociales de S. mystax observadas dentro del área.
Para obtener información detallada sobre el desarrollo ontogénico de la especie, criamos en cautividad 3 individuos (1 macho y 2 hembras), desde la infancia hasta la adultez. Esto nos permitió luego, mayormente en base a los conocimientos adquiridos sobre la cronología del desarrollo dentario, determinar la edad aproximada de todos los individuos inmaduros.
RESULTADOS Y CONCLUSIONES
Distribución geográfica
Los datos obtenidos en los censos y recorridos por las cuencas de Pacaya, Tapiche, Ucayali, Amazonas y muchos de sus afluentes, en el período 1975- 1981, junto con los datos presentados por Hershkovitz (1968, 1977) sobre la
distribución geográfica general de S. mystax, nos permiten hacer el siguiente delineamiento de la distribución geográfica de la especie en la Amazonía Peruana.
Los Ríos Amazonas y Yavarí forman el límite septentrional y oriental de la distribución; el Bajo Ucayali, desde su boca hasta la boca del Río Tapiche, y el curso del Tapiche, aguas arriba, hasta aproximadamente 6040,S, forman el límite nor-occidental de la distribución de S. mystax, desde aquel punto hacia el sur, llega hasta la margen derecha del Río Ucayali. Los límites meridionales de la distribución no pudieron ser definidos en el presente estudio y el único registro de localidad de S. mystax al Sur de Contamana es un lugar llamado "Lagarto" que, según Hershkovitz (1977), está ubicado en la margen derecha del Alto Río Ucayali, en 1004FS, 73048'0. La Fig. 1 presenta los límites de la distribución de la especie, de acuerdo con los conocimientos actuales sobre el particular.
En el transcurso de la evaluación y estudio intensivo de la fauna primatológica del Pacaya, iniciados en junio 1979, hemos podido constatar la definitiva ausencia de S. mystax en dicha zona. La distribución de la especie aparentemente no abarca la Reserva Nacional Pacaya-Samiria, ya que la especie tampoco ha sido reportada en el Samiria. Por consiguiente, cabe notar que ninguna de las Unidades de Conservación existentes en la Amazonía Peruana incluye poblaciones de esta especie.
Hábitat
El hábitat de S. mystax consiste en bosques heterogéneos primarios y secundarios; también frecuenta cultivos frutales mixtos. Su hábitat abarca los tres tipos de subpaisajes dados en la clasificación fisiográfica de ONERN
(1975) para la región (Llanura de Inundación, Llanura de Sedimentación y Colinas Bajas) y principalmente las siguientes unidades fisiográficas en ellos: T1W2p, T1W2e, T20 T2D, Cbmd y Cbfd.
Contrario al "pichico cornún" (Saguinus fuscicollis), S. mystax ocupa, por regla general, sólo marginalmente las extensiones mayores de Llanuras de Inundación. Esto es probablemente debido a que esta especie es más dependiente de una continua disponibilidad de frutos para el sustento que S. fuscicollis y, según hemos podido observar, la producción de frutos (y aparentemente de insectos también) es marcadamente más estacional en la Llanura de Inundación que en los otros tipos de terrenos habitados por la.especie, resultando casi completa ausencia de frutos en la temporada más seca del año. S. fuscicollis, debido a su menor requerimiento de energía por su menor tamaño, durante la temporada de escasez de frutos, es capaz de subsistir de otros recursos, tales como exudados y néctar (Soini, este volumen), que
generalmente no existen en concentraciones suficientemente grandes para la subsistencia de S. mystax, que los consume sólo en forma suplementaria.
Características físicas y determinación de la edad
Al examinar los individuos capturados, éstos fueron inicialmente agrupados en las siguientes 5 categorías de edad:
Infantes. Tamaño muy pequeño; cargados por otros miembros de la manada; lactantes.
juveniles. Tamaño pequeño; genitales muy pequeños y despigmentados; glándula suprapúbica ausente.
Subadultos. Tamaño adulto o casi adulto; testes descendidos; escroto con una faja basal de pigmentación negra; vulva pequeña, no turgente; sin prominencia glandular suprapúbica.
Adultos. Tamaño adulto; pigmentación escrotal en forma de manchas dispersas; vulva grande; una prominencia glandular suprapúbica a menudo presente (sólo en hembras).
Adultos vicios. Dentadura muy desgastada y deteriorada; piel desmida parcialmente despigmentada.
Posteriormente, los conocimientos adquiridos sobre el desarrollo dentario y otros aspectos del desarrollo ontogénico, presentados a continuación, permitieron estimar la edad cronológica aproximada de los individuos inmaduros y definir con mayor precisión las categorías de edad utilizadas en el presente análisis poblacional.
Desarrollo dentario
El estudio detallado del desarrollo dentario de 3 individuos y observaciones adicionales en otros individuos inmaduros criados en cautiverio, indicaron que la secuencia y cronología de la erupción de los dientes son relativamente constantes en S. mystax y que la edad de los individuos inmaduros puede ser estimada mediante examen dentario con relativamente buena precisión hasta la edad de un año y con menor exactitud hasta 1,5 años (Los métodos y resultados pormenorizados del estudio del desarrollo dentario y ontogénico en general de Cebuella pygmaea, Saguinus fuscicollis y S. mystax serán presentados en un trabajo posterior.)
Las uencias de erupción de los dientes fueron las siguientes:
Maxila M1 - 11 - 12 - M2 - P3 - P2 - P1 - C
Mandíbula : NI1 - 11 - 12 - M2 - P3 - P1 - P2 - C
Los dientes maxilares P1, P2 y C erupcionaron
generalmente antes que sus contrapartes mandibulares; mientras que los dientes
mandibulares M2 erupcionaron antes que sus contrapartes maxilares. Los M1, 11,
12 y P3 maxilares y mandibulares erupcionaron casi simultáneamente. La
edad aproximada de erupción de cada diente permanente fue la siguiente:
| Maxila | Mandíbula | |
| I1 |
|
|
| I2 |
|
|
| C |
|
|
| P1 |
|
|
| P2 |
|
|
| P3 |
|
|
| M1 |
|
|
| M2 |
|
|
La cronología aproximada del crecimiento de los caninos superiores fue la siguiente (medido desde el borde anterior de la gingiva hasta la punta del canino):
|
Longitud de canino |
|
| 1,5 mm |
|
| 2,0 mm |
|
| 2,5 mm |
|
| 3,0 mm |
|
| 3,5 mm |
|
| 4,0 mm |
|
| 4,5 mm |
|
| 5,0 mm |
|
| 6,0 mm |
|
| 6,5 mm |
|
En S. mystax los caninos superiores alcanzan un tamaño máximo de 6,5
7 mm, aproximadamente. El rango del tamaño de caninos aparentemente intactos observado en los adultos es 6-7 mm, lo que generalmente es alcanzado a los 16-19 meses de edad. No obstante, cabe notar que el crecimiento de los caninos puede tener considerable variación individual, particularmente a partir de los 5,0 mm de longitud; pero en muchos individuos el rango adulto es alcanzado antes de la llegada a la madurez sexual y, por consiguiente, la longitud de los caninos no sirve como un criterio único y absoluto para la distinción entre los subadultos y los adultos jóvenes.
Desarrollo de los genitales en los machos
Los testes descienden al escroto normalmente a los 7-8 meses de edad y alcanzan el tamaño observado en los adultos a los 17-18 meses. En los machos inmaduros la parte basal del escroto presenta una faja continua de pigmentación negra. Al dilatarse el escroto, esta faja se fracciona y forma un patrón de manchas negras sobre el escroto. En la gran mayoría de individuos, las manchas aparecen aproximadamente cuando los testes alcanzan el rango del tamaño testicular de los adultos, señalando la llegada a la madurez sexual. Por consiguiente, la presencia de las manchas escrotales sirve, en la mayoría de los casos, para distinguir los adultos jóvenes (= sexualmente maduros) de los subadultos. En los machos, en que la pigmentación está en transición del patrón subadulto al patrón adulto, la segregación fue hecha a base del tamaño testicular: Todos los machos con el tamaño testicular dentro del rango observado en los machos de mayor edad (= con caninos desgastados) fueron considerados sexualmente maduros e incluidos en la categoría de adultos.
En la Fig. 2 se describe la relación entre
las categorías de "edad dentaria".y el tamaño
de los testes. Un atrofiamiento de los testes fue evidente en los machos seniles
examinados en el Manití y Tapiche, probablemente debido a la pérdida
de la virilidad reproductiva, por lo que fueron excluidos del cómputo
del tamaño mínimo para los testes de los machos sexualmente maduros.
En base a las muestras disponibles, el límite inferior del tamaño
testicular adulto fue fijado en 490 mm para la población del Tapiche
y en 510 Mm
3 para las del Tahuayo y Manití. El tamaño testicular para los subadultos y para los diferentes niveles de edad adulta (definidos más adelante) se presentan en el Cuadro 1.
Desarrollo de los genitales en las hembras
La vulva de las hembras inmaduras es relativamente pequeña, de consistencia firme y de forma algo convexa. La vulva de las hembras sexualmente maduras es más grande, algo turgente, blanda y de forma más bien aplanada. La transformación de la vulva sucede generalmente a los 15-17 meses de edad, señalando la llegada a la madurez sexual. Por consiguiente, el tamaño de la vulva permite distinguir las adultas jóvenes de las subadultas.
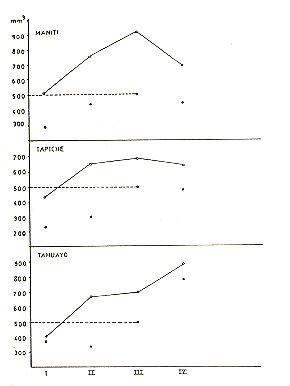
Fig.2. - Relación entre el tamaño
de los testes y la "edad dentaria" en S. mystax de 3 poblaciones
estudiadas. Los círculos interconectados
indican los valores promedios del tamaño testicular y lod círculos
negros debajo de estos señalan los límites inferiores de los
respectivos rangos. I. = Caninos intactos, de 5 mm o más de longitud;
pigmentación escrotal de forma juvenil
(= sin manchas sobre el escroto). II = Dentadura como I, pero la pigmentación
escrotal de forma adulta
(= manchitas dispersas sobre el escroto). III = Caninos con desgaste. IV = Dentadura
muy desgastada y deteriorada.
Para el cómputo del tamaño testicular, ver cuadro 1.
En el presente análisis, todas las hembras con el tamaño de la vulva dentro del rango observado en las adultas mayores (con caninos desgastados) fueron consideradas sexualmente maduras e incluidas en la categoría de adultos. El tamaño de la vulva fue expresado mediante la suma de la longitud y máximo ancho de la vulva. El índice resultante para distinguir las adultas jóvenes de las subadultas fue 24 para la población de Tapiche y 26 para las de Tahuayo y Manití (Fig. 3). El tamaño de la vulva (longitud + ancho) para las subadultas y los diferentes niveles de edad adulta son presentados en el Cuadro 1. En S. mystax la vulva es despigmentada tanto en las hembras maduras como en las inmaduras.
Cuadro 1 .- Tamaño de los testes y de
la vulva en subadultos y adultos procedentes de tres poblaciones naturales.
|
Testes: |
X + E.E. (n) |
X + E.E. (n) |
X + E.E. (n) |
||||||
|
Subadultos |
381 | 19 | (15) | 398 | 20 | (5) | 417 | 36 | (8) |
| Adultas jóvenes | 665 | 20 | (32) | 664 | 34 | (18) | 770 | 33 | (32) |
| Adultas mayores | 674 | 20 | (22) | 696 | 44 | (13) | 910 | 48 | (32) |
| Adultas viejas | 629 | 101 | (4) | 883 | 59 | (4) | 683 | 51 | (10) |
| Todos adultos | 671 | 15 | (58) | 711 | 25 | (35) | 830 | 30 | (74) |
|
Vulva: |
20,1 | 0,4 | (17) ¼ | 20,7 |
1,6 |
(6) |
22,1 |
0,9 |
(7) |
| Adultas jóvenes | 29,3 | 0,7 | (25) | 33,1 | 1,4 | (12) | 39,6 | 1,3 | (30) |
| Adultas mayores | 31,7 | 1,0 | (25) | 34,9 | 1,0 | (17) | 38,1 | 1,6 | (25) |
| Adultas viejas | 32,5 | 4,5 | (2) | 38,2 | 1,7 | (6) | 33,6 | 2,2 | (4) |
| Todas adultas | 30,4 | 0,6 | (52) | 34,8 | 0,8 | (35) | 38,5 | 0,9 | (59) |
Testes: El tamaño de los testes está expresado en mm3, basado en las medidas del teste derecho y calculado mediante la ecuación: volumen = p1 xy2/6, donde x = longitud del teste; y ancho del teste (las medidas fueron tomadas exterior mente, estirando suavemente la piel escrotal sobre el teste).
Vulva: El tamaño de la vulva es expresado mediante la suma de la longitud y máximo ancho de la vulva.
Adultos jóvenes = nivel de edad A; Adultos mayores = nivel de edad B y C; Adultos viejos = nivel de edad D.
Desarrollo de la glándula suprapúbica
Las hembras adultas de S. mystax presentan una conspicua prominencia de piel glandular en la región suprapúbica. En los machos es menos desarrollada y no se observa la prominencia como en las hembras. En las hembras sub-aduItas la prominencia suprapúbica no está todavía presente y aparece, en forma incipiente, a los 17-18 meses de edad, o más tarde. Por consiguiente, la presencia de la prominencia suprapúbica es un indicador seguro de la madurez sexual. Sin embargo, la ausencia de la prominencia no siempre indica inmadurez sexual, ya que algunas de las hembras de edad evidentemente madura examinadas carecían de ella.
Definición de las categorías de edad
Los datos que acabamos de presentar, nos permiten definir con mayor precisión las categorías de edad utilizadas en los análisis de peso y tamaño y de la estructura poblacional de S. mystax:
Infantes. Edad 0-3 meses. Tamaño muy pequeño; sólo dientes de leche presentes; lacta; cargado constantemente o intermitentemente por otros miembros de la manada.
juveniles. Edad 4-12 meses. Tamaño pequeño; locomoción completamente independiente; dentadura mixta o permanente, con caninos de leche o permanentes en desarrollo (menores de 5 mm); testes inguinales, o descendidos y muy pequeños.
Subadultos. Edad 13-18 (+) meses. Tamaño como los adultos o un poco menor; caninos maxilares 5 mm o más; pigmentación escrotal en forma de una faja basal; testes relativamente pequeños (menores de 450-510 mm3); vulva firme, convexa y de relativamente pequeño tamaño (índice de tamaño menor de 24-26); prominencia suprapúbica ausente.
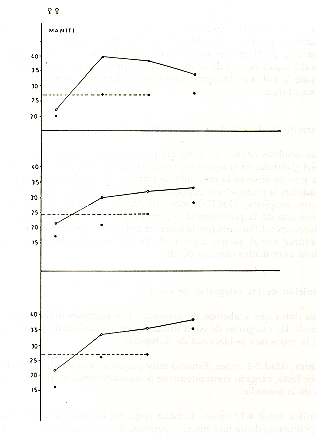
Fig. 3. - Relación entre el tamaño de la vulva y la "edad dentaria" en S. mystax de tres poblaciones estudiadas. Los círculos interconectados indican los valores promedio del tamaño de la vulva y los círculos negros debajo de estos señalan los límites inferiores de los respectivos rangos, I = Caninos intactos, de 5 mm o m{as de longitud; sin prominencia suprápúbica. II = Dentadura como en I, pero prominencia suprapúbica presente. III = Caninos con desgaste. IV = Dentadura muy desgastada y deteriorada. Para el cómputo del tamaño de la vulva, ver Cuadro 1.
Adultos. Edad 17 meses o más. Tamaño adulto; caninos completamente desarrollados; pigmentación escrotal en forma de manchas; testes relativamente grandes (mayores de 490 mm1); vulva turgente y relativamente grande (índice de tamaño mayor de 24-26); prominencia suprapúbica a menudo presente.
La categoría de adultos fue subdividida en 4 niveles de edad según el grado de desgaste dentario, detallado más adelante.
Tamaño
En la población del Manití (Los Angeles), donde la longitud del cuerpo.(cabeza + cuerpo) de los adultos variaba desde 183 mm hasta 259 mm y la cola medía de 343 mm a 429 mm (incluye sólo las colas aparentemente intactas). Las hembras reportaron una mayor longitud del cuerpo que los machos (Cuadro 2); la diferencia es relativamente pequeña, pero estadísticamente significativa (t= 2,43; g.1. 133; P < 0,02). La longitud de la cola no fue significativamente diferente entre los sexos (P > 0,05). También en la población del Yarapa, examinada por Moya et al. (este volumen), la longitud total de las hembras resultó ligeramente mayor que la de los machos.
Cuadro 2 .- Longitud del cuerpo (= cabeza +
cuerpo) y de la cola en las diferentes categorías de edad de la población
de S. mystax de la cuenca del Río Manití (Los Angeles).
| X + E.E (n)
Longitud de cuerpo (mm) |
X + E.E (n) Longitud cola (mm) |
||||||
|
Adultos |
M | 241,7 | 0,98 | (75) | 382,3 | 2,07 | (72) |
|
H |
245,8 |
1,43 |
(60) |
387,3 |
2,77 |
(57) |
|
|
Subadultos |
M |
237,3 |
2,52 |
(9) |
381,1 |
6,64 |
(9) |
|
H |
239,6 |
5,79 |
(7) |
388,8 |
6,12 |
(7) |
|
| juveniles* |
MH |
218,7 |
2,63 |
(30) |
363,6 |
3,92 |
(30) |
|
Infantes** |
MH |
123,8 |
6,67 |
(9) |
196,4 |
15,07 |
(9) |
|
rango |
(n) |
rango |
(n) |
||||
|
Neonatos*** |
MH |
93(100) |
(5) |
126(137) |
(5) |
||
* La edad estimada de los
juveniles de la muestra variaba de 5,5 a 11 n~. Los respectivos rangos de longitud
fueron: 183-244 mm y 315-392 mm.
** La edad estimada de los infantes de la muestra variaba
de 0,5 a 2,5 m~. Los respectivos rangos de longitud fueron: 105-160 mm y 145-264
mm.
*** La edad de los neonatos de la muestra variaba de 0 a 2 días.
M= machos; H= hembras
La longitud del cuerpo de los subadultos es, en término medio, un poco menor que la de los adultos (Cuadro 2), pero los respectivos rangos se sobreponen ampliamente, eliminando el tamaño corporal como un criterio para distinguir los subadultos de los adultos. No hubo una diferencia significativa de tamaño entre los machos y las hembras subadultas. En los juveniles, e infantes, la comparación de las dimensiones corporales entre mellizos no reveló diferencia alguna entre los machos y las hembras. La longitud del cuerpo de los subadultos y de los juveniles se sobreponen ampliamente, lo que no permite segregarlos por el tamaño, como criterio único.
Peso
El peso de los adultos de las 3.poblaciones examinadas variaba de 360 a 650 g. Esto no incluye las hembras preñadas, para las cuales se registró un peso máximo de 725 g. Entre los adultos, los de edad madura son, en término medio, los más pesados, seguidos por los adultos jóvenes; los adultos seniles son generalmente los de menor peso en la población adulta.
En Río Manití, donde el período de muestreo se extendió desde Setiembre hasta Febrero, es decir, desde la segunda mitad de la estación seca hasta la primera mitad de la estación lluviosa, se observó a partir del mes de Diciembre un incremento general del peso de los animales; así los machos como las hembras adultos pesaron, en término medio, un 5% más en la temporada de Diciembre-Febrero (estación lluviosa) que en la temporada de Setiembre-Noviembre (estación seca y comienzo de la lluviosa). Este fue el caso de la población de Los Angeles como también de la muestra total de adultos (no preñadas) capturados en la cuenca del Manití (N=117 para Setiembre-Noviembre y 115 para Diciembre-Febrero) e indica una fluctuación estacional del peso en las poblaciones naturales de S. mystax, probablemente en relación directa con la fluctuación estacional de los recursos alimentarios de la especie. Las muestras poblacionales de Tahuayo y Tapiche se limitan a las temporadas Agosto-Octubre y Junio-Octubre, respectivamente, y reflejan, por tanto, los pesos de los animales en la estación seca del año.
En las tres poblaciones examinadas, el peso promedio de las hembras adultas no preñadas fue un 4- 7% mayor que el de los machos adultos (Cuadro 3); en las muestras de Manití y Tahuayo esta diferencia es estadísticamente significativa (P < 0,01). El peso promedio de los subadultos es menor que el de los adultos en todas las muestras poblacionales (Cuadro 3); los machos pesaron un 9% menos que los machos adultos y las hembras un 15% menos que las hembras adultas. Sin embargo, los respectivos rangos se sobreponen ampliamente, por lo que el peso no sirve como criterio para distinguir los adultos jóvenes de los subadultos. No hubo diferencia entre los pesos de los machos y de las hembras subadultas en las 3 muestras poblacionales, indicando que las hembras adquieren el mayor peso que los machos recién en la edad adulta.
Los juveniles examinados pesaron entre 200 y 460
g. La comparación de los pesos entre mellizos indicó que los machos
y las hembras juveniles pesan igual. Los pesos de los juveniles y de los subadultos
de las muestras examinadas indican que el peso podría servir de criterio
para distinguir entre estas dos categorías de edad. Salvo un subadulto,
del Tapiche y dos juveniles del Manití, se registraron los siguientes
pesos máximos para los juveniles y mínimos para los subadultos:
|
Juveniles |
Subadultos |
|
|
395 g | 420 g |
|
350 g | 380 g |
|
355 g | 380 g |
Los infantes pesaron entre 80 y 170 g, y los neonatos entre 35
y 50 g.
Cuadro 3 .- Pesos de las diferentes categorías
de edad de S. mystax en tres poblaciones naturales
*. Los pesos son en gramos y fueron registrados con una precisión de
5 g.
|
E.E. |
rango |
(n) |
E.E. |
rango |
(n) |
|||
|
Machos |
Hembras** |
||||||
|
525 | 5,2 | 385(630) | (79) | 561 | 7,3 | 430(650) | (48) |
|
505 | 7,7 | 435(630) | (34) | 540 | 8,3 | 450(630) | (26) |
|
472 | 6,2 | 380(550) | (48) | 490 | 10,1 | 360(580) | (30) |
|
||||||||
|
504 | 14,3 | 420(570) | (10) | 504 | 26,2 | 440(600) | (7) |
|
454 | 14,8 | 400(485) | (5) | 462 | 24,9 | 380(540) | (6) |
|
417 | 12,9 | 380(520) | (14) | 416 | 13,1 | 335(480) | (9) |
|
||||||||
|
349 | 8,6 | 240(460) | (30) | ||||
|
308 | 15,2 | 200(390) | (12) | ||||
|
297 | 9,2 | 200(335) | (18) | ||||
|
80(170) | (6) | ||||||
|
35(50) | (9) |
* Las muestras
de los infantes y neona tos son muestras combinadas de las tres poblaciones.
** Las hembras preñadas fueron excluidas de las muestras.
La comparación de los pesos entre las tres poblaciones indica que los animales del Manití pesan más que los del Tahuayo y que estos últimos pesan más que los del Tapiche; esto es evidente en los adultos y también en los subadultos y juveniles (Cuadro 3). Los pesos de los animales del Yarapa, examinados por Moya el al. (este volumen), se ubican entre los del Tahuayo y los del Tapiche. La proyección de los pesos sobre el mapa de distribución geográfica de S. mystax, indica que la especie muestra una nítida clina geográfica, donde el tamaño de los individuos va paulatinamente disminuyendo de Norte a Sur (Fig. 4).
Correlación entre peso y longitud
La comparación del peso con la longitud del cuerpo en los adultos de la población del Manití indicó la existencia de una correlación muy débil entre estas medidas (r= + 0,38 para los machos y r=+ 0,26 para las hembras). Como era de suponer, en los juveniles en pleno crecimiento la correlación resultó más elevada (r= + 0,66).
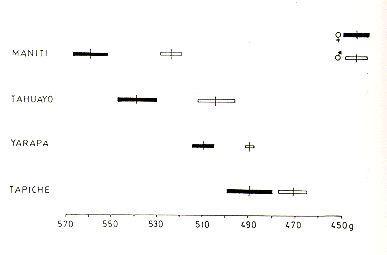
Fig. 4. - Comparación de los pesos
adultos de 4 poblaciones de s. mystax colocados en la
secuencia descendiente Norte - Sur. Las barritas verticales indican los promedios
y las barras
horizontales los respectivos errores estándar.
Estructura poblacional
Las muestras poblacionales examinadas tenían las siguientes composiciones por categorías de edad:
|
Adultos |
Subadultos |
juveniles |
Infantes |
|
| - Tahuayo (n=91) | 76% | 12% | 12% | - |
| - Tapiche (n=165) | 67% | 18% | 15% | - |
| - Manití (n=360) | 68% | 10% | 18% | 4% |
En la población del Manití, donde el periodo de captura se extiende desde Setiembre hasta Febrero, observamos un cambio estacional en la estructura poblacional, debido a la aparición sincronizada de las crías en la población (ver "Reproducción") y a la maduración (casi) igualmente sincronizada de los subadultos (Fig. 5). Esto es evidente al comparar entre sí las muestras poblacionales capturadas antes y durante la temporada de nacimientos:
|
Adultos |
Subadultos |
juveniles |
Infantes |
|
| Set.-Oct. (n=149) | 67% | 13% | 19% | - |
| Nov.-Feb. (n=211) | 69% | 8% | 17% | 6% |
Sin embargo, la proporción adulto/inmaduro no sufrió mayor cambio, subiendo de 2,1 a 2,2, lo que sugiere que dicha proporción se mantiene relativamente estable a través de las temporadas del año y podría servir como un indicador de la condición demográfica de una población de S. mystax. La proporción adulto/inmaduro observada en las tres poblaciones del presente estudio y en la del Yarapa (Moya et al., este volumen) fue la siguiente:
| Manití | 1: | 0,5 |
| Tapiche | 1: | 0,5 |
| Tahuayo | 1: | 0,3 |
| Yarapa | 1: | 0,3 |
|
X = |
1: |
0,4 |
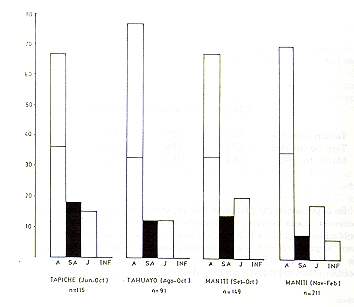
Fig. 4. - Comparación de los pesos
de adultos de 4 poblaciones de S. mystax colocados en la secuencia
descendiente Norte - Sur. Las barritas verticales indican los promedios y las
barras horizontales
los respectivos errores estándar
Para analizar más detalladamente la estructura de la población
adulta, clasificamos los adultos en 4 niveles de edad sucesivos, en base a la
condición dentaria:
A Caninos y otros dientes sin desgaste y no manchados (adultos jóvenes).
B Caninos ligeramente desgastados o rotos; los otros dientes intactos, a menudo algo manchados (adultos de edad intermedia).
C Caninos considerablemente desgastados; los otros dientes manchados y a menudo algo desgastados (adultos de edad madura).
D Caninos y la dentadura en general muy desgastada y deteriorada (adultos viejos o seniles).
De los adultos examinados en las tres poblaciones, el 49% fueron clasificados en el Nivel A (Cuadro 4), indicando que aproximadamente la mitad de los adultos de las poblaciones naturales son adultos jóvenes. Si comparamos la proporción de éstos con la proporción de subadultos y juveniles en las poblaciones examinadas (Fig. 5), podemos deducir que la edad de la mayoría de estos adultos jóvenes es de 2 a 3 años. El 16% de los adultos son de edad intermedia (Nivel B) entre los adultos jóvenes y maduros. El 36% son de edad madura, incluyendo los viejos que forman un 10% de la población adulta. Como se puede ver en el Cuadro 4, las tres poblaciones tienen una estructura de edad bastante similar. La Fig. 5 presenta el perfil poblacional de S. mystax, basado en las 3 muestras combinadas. La preponderancia de machos es evidente en las categorías de juveniles, subadultos y adultos jóvenes.
Proporción macho/hembra
La proporción macho/hembra por categorías de edad en las tres muestras poblacionales, expresada en número de hembras por cada macho, fue la siguiente:
|
Tapiche |
(n=) |
Manití |
(n=) |
Tahuayo |
(n=) |
Total |
(n=) |
|
|
0,9 | (110) |
0,8 |
(267) | 0,8 | (46)* |
0,8 |
(423) |
|
0,7 | (30) | 0,9 | (36) | 1,2 | (11) | 0,8 |
(77) |
|
0,7 | (25) | 0,8 | (65) | 1,2 | (11) | 0,8 |
(101) |
|
0,8 | (165) | 0,8 | (368) |
0,9 |
(68) |
0,8
|
(601) |
*Esta muestra incluye sólo los adultos de las manadas capturadas completas, debido a que la comparación de la composición de las siete manadas capturadas incompletas con la de las manadas capturadas completas, reveló que la proporción macho/hembra en las primeras estaba fuertemente desviada de la proporción observada en las manadas completas, en cuanto a los adultos (sin embargo, la inclusión de aquella sub-muestra desviada no hubiera alterado los valores de la columna "Total'. Tal medida no fue necesaria en las otras muestras, ya que no hubiera alterado las proporciones encontradas en las muestras completas.
Cuadro 4 .- Estructura de edad y sexo de la población
adulta en tres poblaciones de S. Mystax. Las cifras indican los porcentajes
de cada componente de la respectiva población adulta.
|
(n=) |
Niv. edad A |
Niv.edad B |
Niv.edad C | Niv. edad D | |||||||||
|
M |
H |
T |
M |
H |
T |
M |
H |
T |
M |
H |
T |
||
| Tapiche | -110 | 30 | 24 | 54 | 8 | 11 | 19 | 11 | 111 | 22 | 4 | 2 | 5 |
| Tahuayo | -69 | 25 | 17 | 42 | 6 | 6 | 12 | 13 | 19 | 32 | 6 | 9 | 14 |
| Manití | -139 | 27 | 22 | 49 | 8 | 7 | 15 | 14 | 11 | 25 | a | 4 | 11 |
| Todos | -318 | 28 | 21 | 49 | 8 | 8 | 16 | 13 | 13 | 26 | 6 | 4 | 10 |
M = machos; H = hembras; T = machos + hembras.
Una preponderancia notablemente uniforme de machos es evidente en la muestra total y en todas las tres poblaciones y categorías de edad, salvo en la muestra del Tahuayo, que es probablemente inadecuada por su reducido tamaño. Aunque la prueba del chi-cuadrado indicó que ninguna de las proporciones desviaba significativamente de la proporción 1:1 (P > 0,05), la persistente incidencia de menos hembras que machos en todas las muestras de adecuado tamaño nos sugiere que se trate de un fenómeno demográfico real.
Para averiguar si la desproporción entre los sexos podría ser debido a que los machos son más propensos a ser capturados que las hembras, comparamos, en el Manití, una muestra de 19 manadas, que fueron sometidas a observaciones más detenidas y a repetidos conteos de sus miembros antes de ser capturadas evidentemente completas, con la muestra total capturada en la citada cuenca. " proporción macho/hembra encontrada en aquella muestra (a) y en la muestra total (b) de la cuenca fueron virtualmente idénticas, a saben
|
a) |
b) |
|
| Adultos | 1: 0,76 | 1: 0,78 |
| Todos | 1: 0,81 | 1: 0,79 |
Esto nos sugiere que la muestra total del Manití es representativa de la población y que la preponderancia de los machos en las muestras no sería debido a una diferencia entre los sexos en cuanto a la propensión de ser atrapados
Hembras reproductivas
De todas las hembras adultas examinadas, aproximadamente el 44% eran reproductivas (preñadas, con crías lactantes y sin ellas). La proporción de hembras reproductivas en cada nivel de edad (a) y su contribución a la población total de hembras reproductivas (h), fueron:
|
a) |
b) |
|
| Nivel A | 13% | 14% |
| Nivel B | 40% | 15% |
|
Nivel C |
83% |
52% |
| Nivel D | 100% | 19% |
Las cifras correspondiente de cada población examinada están dadas en el Cuadro 5. De los datos disponibles, podemos concluir que la gran mayoría de las hembras reproductivas pertenecen a los 2 niveles más altos de edad (Fig. 6) y que en las poblaciones naturales las hembras reproducen generalmente recién a partir de los 3-4 años de edad.
Cuadro 5 .- Distribución de las hembras
reproductivas (= preñadas, Iactantes o post-lactantes) por los niveles
de edad. Las cifras indican los porcentajes de hembras reproductivas del número
total de hembras presentes (n) en el respectivo nivel de edad.
|
Nivel A |
Nivel B |
Nivel C |
Nivel D |
Todos |
||||||
|
% |
(n) |
% |
(n) |
% |
(n) |
% |
(n) |
% |
(n) |
|
| Tapiche | 8 | (26) | 33 | (12) | 92 | (12) | 100 | (2) | 37 | (52) |
| Tahuayo | 17 | (12) | 25 | (4) | 77 | (13) | 100 | (6) | 54 | (35) |
| Manití | 16 | (30) | 56 | (9) | 81 | (16) | 100 | (4) | 45 | (60) |
| (Los Angeles) | ||||||||||
|
Todas |
13 |
(68) |
40 |
(25) |
83 |
(41) |
100 |
(12) |
44 |
(146) |
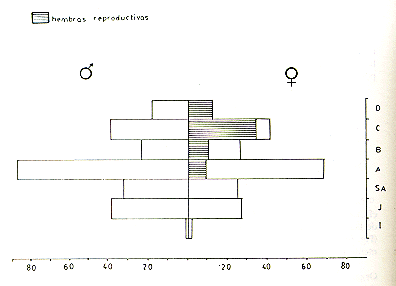
Fig. 6. - Perfíl poblacional de
S. mystax, basado en las muestras poblacionales combinadas del Manatí
(Los Angeles),
Tahuayo y Tapiche. I = infantes; J = juventud; Sa = subadultos; A = adultos
jóvenes; B = adultos de edad intermedia;
C = adultos de edad madura; D = adultos viejos.
Organización social
Como en los otros Callitrícidos que hemos estudiado en su ambiente natural (Soini 1982, este volumen), el núcleo de la organización social de S. mystax es la manada formada básicamente por una hembra reproductiva, su pareja (el macho dominante de la manada) y su prole de hasta 3 camadas sucesivas. A éste se agregan a menudo 1-3 adultos adicionales, mayormente machos y/o hembras jóvenes, algunos de los cuales indudablemente pertenecen a la prole adulta de la hembra reproductora. Aunque sólo una hembra por manada reproduce, es posible que no todas las camadas de la hembra sean engendradas por el mismo macho, porque en varias manadas observamos la presencia simultánea de 2 machos de mayor edad, lo que no fue observado en las hembras. Estas manadas reproductivas ocupan territorios que son defendidos contra otras manadas e individuos de la especie. No obstante, se observan asociaciones temporarias entre manadas contiguas (denominadas -asociaciones mayores"), tratándose probablemente de casos de uniones entre manadas emparentadas.
Aparte de las manadas reproductivas, se observan grupos o manadas de reducido tamaño, que carecen de infantes y juveniles y que, al parecer, no poseen territorio propio. Juzgando por su composición, analizada más adelante, se trata de grupos transitorios y manadas incipientes, formadas mayormente por adultos jóvenes que recientemente se han desligado (o están en proceso de desligarse) de sus manadas natales. También observamos, en tres
oportunidades, individuos aparentemente solitarios, (por lo menos temporalmente); todos eran hembras adultas jóvenes, nulíparas.
Tamaño de las manadas
El tamaño promedio de las manadas y asociaciones para las tres poblaciones estudiadas fue de 5,3 individuos de locomoción independiente (se excluye las crías cargadas). El tamaño modal fue 5 y el rango observado 2-12 (Fig. 7). El tamaño promedio (± error estándar), el tamaño modal y el rango de las manadas reproductivas para las tres poblaciones y para la muestra total fueron los siguientes:
| Manití | (n=18) | 5,0 + 0,4 | 4 | (3-8) |
| Tapiche | (n=20) | 6,3 + 0,4 | 7 | (3-9) |
| Tahuayo | (n=1 1) | 4,5 + 0,3 | 5 | (3-6) |
|
Total |
(n=49) |
5,5 + 0,2 |
5 |
(3-9) |
El análisis de varianza indicó la existencia de una diferencia estadísticamente significativa entre las muestras poblacionales (F= 5,84; P < 0,01), lo que nos permite concluir que las manadas reproductivas del Tapiche, en término medio, son más grandes que las de las otras cuencas. En el Tapiche, la densidad poblacional de la especie es notablemente más baja que en el Manití y el Tahuayo (posiblemente debido a la calidad marginal de su hábitat), lo que nos sugiere la existencia de una correlación inversa entre la densidad poblacional y el tamaño de las manadas en S. mystax.
El tamaño de las manadas transitorias o incipientes oscilaba de 2 a 4 individuos, pero fue casi siempre de 3 individuos (en el 85% de los casos). Las asociaciones mayores variaban de 9 a 12 individuos de locomoción independiente.
Diferencias estacionales en el tamaño de las manadas
En el Río Manití, donde el período de captura y estudio se extendió d~ Setiembre hasta Febrero, observamos, a partir de la segunda mitad de Octubre, un notable incremento relativo de las manadas de reducido tamaño, resultando una marcada reducción en el tamaño modal de las manadas (Fig. 8). El promedio del tamaño (+ error estándar) sufrió la siguiente reducción:
Setiembre - 1ra. mitad de Octubre (n=32) 5,9+0,6
2da. mitad de Octubre - Febrero (n=63) 4,9 ± 0,2
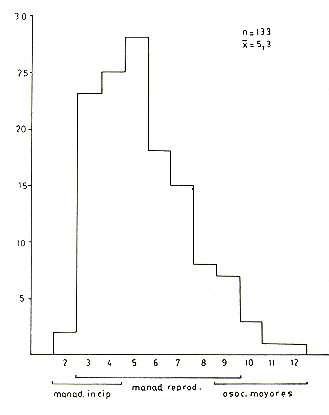
Fig. 7. - La distribución de frecuencias
del tamaño de las manadas y asociaciones de S. mystax
observadas en Manití, Tahuayo y Tapiche.
El análisis estadístico (unidireccional) indicó que la reducción observada fue significativa (t= 1,79; g.l. 80; P < 0,05). La composición de las manadas pequeñas reveló que se trataba, en muchos de los casos, de manadas transitorias o incipientes, compuestas únicamente por 2-3 adultos (modalmente de 2 machos y 1 hembra). A base de nuestras observaciones concluimos que en vísperas del inicio de la temporada de nacimientos (ver "Reproducción"), principalmente en Octubre-Noviembre, ocurre un fraccionamiento más general de las manadas reproductivas, debido a que los subadultos/adultos
jóvenes se desligan de sus manadas natales temporalmente o definitivamente y forman las manadas transitorias o incipientes.
Composición de las manadas
En las manadas reproductivas, el número de adultos varió de 2 a 6; en el 63% de los casos fue 3 ó 4. El número de machos y de hembras adultas oscilaba de 1 a 3, respectivamente, salvo un caso de 4 machos en el Manití y otro de 4 hembras en el Tapiche (Fig. 9). Sin embargo, las manadas tenían frecuentemente más machos adultos que hembras adultas (en un 37% de los casos) y sólo raras veces más hembras adultas que machos adultos (en un 12% de los casos). Por consiguiente, el número promedio de machos adultos por manada fue mayor que la de hembras en todas las poblaciones estudiadas:
|
|
Machos |
Hembras |
|
2,1 | 1,4 |
|
2,2 |
1,9 |
|
2,0 | 1,5 |
|
2,1 |
1,6 |
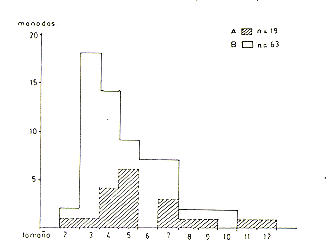
Fig. 8. - Diferencia estacional en el
tamaño de las manadas y asociaciones: A = distribución de frecuencia
del tamaño
en Setiembre a 15 de Octubre; B = en 2da. mitad de Octubre a Febrero; en la
población de S. mystax de Manití.
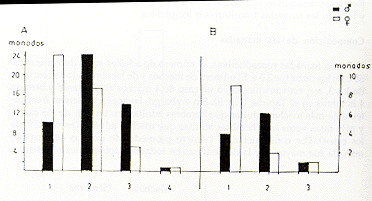
Fig. 9. - Distribución de frecuencias
del número de machos adultos y de hembras adultas en las manadas
de S. mystax de 3 poblaciones naturales de Tapiche, Tahuayo y Manití
(Los Angeles).
A = manadas reproductivas; B = manadas transitorias o incipientes
El examen de la composición adulta de las manadas reproductivas capturadas completas (Cuadros 6-8), revela que en las manadas con 2 ó más hembras adultas, sólo hay una de edad mayor (de Nivel C o D), siendo las otras adultas de edad joven (de Nivel A), o en algunos casos de edad intermedia (de Nivel B); mientras que entre los machos se observan a veces hasta 2 de edad mayor o, con más frecuencia, uno de edad C-D y otro de edad B. La hembra de edad mayor fue siempre la única reproductora de su manada. Esta diferencia en la composición adulta probablemente refleja una mayor intolerancia por parte de la hembra reproductora hacia otras hembras, incluyendo sus propias hijas subadultas/adultas, que hacia otros individuos de su especie. La presencia de un menor número de hembras subadultas y adultas jóvenes que machos de la misma edad en las manadas reproductivas, podría indicar que generalmente las hembras abandonan sus manadas natales en una edad más temprana que los machos.
El número de individuos inmaduros (infantes, juveniles y subadultos) en las manadas reproductivas variaba de 0 a 4. En contraste a lo observado en Cebuella pygmaea y Saguinus fuscicollis (Soini 1982, este volumen), ninguna manada de S. mystax contenía individuos inmaduros procedentes de más de 2 camadas sucesivas. Esto es indudable debido a que los intervalos entre partos sucesivos son más largos en S. mystax que en los otros Callitrícidos simpátricos.
Las manadas transitorias o incipientes estaban formadas por 2 a 4 individuos, pero casi siempre de 3. Salvo un grupo de 3 hembras y otro de 3 machos, tenían 1 a 2 hembras. Hubo una alta preponderancia de machos, siendo la composición modal 2 machos + 1 hembra y el promedio de machos por manada 1,6 y de hembras 1,2. Estas manadas carecían de hembras reproductivas y de infantes y juveniles. La mayoría de los integrantes fueron adultos jóvenes (Cuadros 6-8) y sólo 3 individuos (todos machos) fueron de edad mayor.
Cuadro 6 .- Composición de las manadas
de S. mystax capturadas aparentemente completas en Los Angeles, Río
Manití.
|
No. |
Adultos mayores |
dultos intermedios |
Adultos jóvenes |
Subadultos |
juveniles |
Infantes |
Total* |
||||||
|
I |
M |
H |
M |
H |
M |
H |
M |
H |
M |
H |
M |
H |
|
| 1) | (1) | 1 | 2 | 1 | 5 | ||||||||
| 3) | 1 | 1 | 2 | 1 | 1 | 1 | 1 | 8 | |||||
| 7) | 1 | 1 | 1 | 1 | 1 | 5 | |||||||
| 9) | 1 | 1 | 1 | 1 | 4 | ||||||||
| 11) | 2 | 1 | 1 | 4 | |||||||||
| 13) | 1 | 1 | 1 | 1 | 1 | 5 | |||||||
| 15) | 1 | 1 | 1 | 1 | 2 | 2 | 8 | ||||||
| 17) | 1 | 1 | 1 | 1 | 1 | 1 | 6@ | ||||||
| 29) | 1 | 2 | 1 | 2 | 1 | 1 | 1 | 9 | |||||
| 31) | 1 | 2 | 3 | ||||||||||
| 35) | (1) | 1 | 1 | 1 | 4 | ||||||||
| 37) | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 7 | |||||
| 39) | 2 | 1 | 3 | ||||||||||
| 45) | 2 | 1 | 1 | 4 | |||||||||
| 53) | 1 | 1 | 2 | 1 | 2 | 7 | |||||||
| 61) | 2 | 1 | 1 | 1 | 1 | 1 | 7 | ||||||
| 65) | 1 | 1 | 1 | 1 | 4 | ||||||||
| 67) | 1 | 2 | 1 | 4 | |||||||||
| 75) | 1 | 1 | 1 | 1 | 3 | ||||||||
| II | |||||||||||||
| 5) | 2 | 1 | 3 | ||||||||||
| 23) | -2 | 1 | 3 | ||||||||||
| 27) | 2 | 1 | 3 | ||||||||||
| 33) | 2 | 2 | 4 | ||||||||||
| 41) | 1 | 1 | 1 | 3 | |||||||||
| 77) | 2 | 1 | 3 | ||||||||||
| 79) | 2 | 1 | 3 | ||||||||||
| 81) | 2 | 1 | 3 | ||||||||||
| 89) | 1 | 1 | 1 | 3 | |||||||||
I = manadas reproductivas
II = manadas transitorias o incipientes
M = Machos; H = hembras; 0 = nivel de edad tentativo
@ = Asociación de 2 manadas
* = No incluye las crías cargadas
Cuadro 7 .- Composición de las manadas
de S. mystax capturadas aparentemente completas en la cuenca del Río
Tapiche.
|
No. |
Adultos mayores |
Adultos intermedios |
Adultos jóvenes |
Subadultos |
juveniles |
Infantes |
Total* |
||||||
|
I |
M |
H |
M |
H |
M |
H |
M |
H |
M |
H |
M |
H |
|
| 1) | (1) | 1 | 2 | 1 | 1 | 6 | |||||||
| 2) | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 7 | |||||
| 3) | 1 | 1 | 1 | 1 | 2 | 2 | 1 | 8 | |||||
| 4) | 1 | (1) | 2 | 1 | 1 | 6 | |||||||
| 7) | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | ||||
| 8) | (1) | 1 | 1 | 1 | 1 | 5 | |||||||
| 10) | 1 | 1 | 2 | 1 . | 1 | 6 | |||||||
| 11) | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 1 | 9 | ||||
| 13) | 1 | 1 | 1 | 2 | 1 | 1 | 7 | ||||||
| 14) | 1 | 1 | 2 | 4 | |||||||||
| 15) | 1 | (1) | 1 | 1 | 1 | 5 | |||||||
| 17) | 1 | 1 | 2 | 1 | 5 | ||||||||
| 19) | 1 | 1 | 1 | 2 | 2 | 1 | 2 | 10@ | |||||
| 20) | 1 | 1 | 2 | 2 | 1 | 1 | 8 | ||||||
| 21) | 1 | 1 | 1 | 1 | 1 | 4 | |||||||
| 23) | 1 | 2 | 1 | 1 | 1 | 7 | |||||||
| 25) | 1 | 1 | 1 | 1 | 1 | 1 | 2 | 8 | |||||
| 26) | 1 | 1 | 2 | 1 | 1 | 6 | |||||||
| 27) | 1 | 1 | 1 | 1 | 1 | 2 | 7 | ||||||
| 28) | 1 | 1 | 1 | 1 | 1 | 2 | 7 | ||||||
| 29) | 1 | 1 | 1 | 3 | |||||||||
| II | |||||||||||||
| 6) | 1 | 1 | 2 | ||||||||||
| 12) | 1 | 2 | 3 | ||||||||||
| 18) | 1 | 1 | 1 | 3 | |||||||||
| 24) | 1 | 1 | 3 | ||||||||||
I = manadas reproductIvas
II = manadas transitorias o incipientes
M = Machos; H = hembras; ( = nivel de edad tentativo
= Asociación de 2 manadas
= No incluye las crías cargadas
Cuadro 8 .- Composición de las manadas
de S. mystax capturadas aparentemente completas en la cuenca del Río
Tahuayo.
|
No. |
Adultos mayores |
Adultos intermedios |
Adultos jóvenes |
Subadultos |
juveniles |
Infantes |
Total* |
||||||
|
I |
M |
H |
M |
H |
M |
H |
M |
H |
M |
H |
M |
H |
|
| 2) | 1 | 1 | 1 | 1 | 4 | ||||||||
| 11) | 1 | 1 | 2 | 1 | 5 | ||||||||
| 17) | 1 | 1 | 1 | 1 | 1 | 5 | |||||||
| 20) | -1 | 1 | 1 | 1 | 1 | 5 | |||||||
| 21) | 1 | 2 | 1 | 4 | |||||||||
I = manadas reproductivas
M = Machos; H = hembras; 0 = nivel de edad tentativo
Reproducción
Aunque no existen publicaciones sobre la blología reproductiva de S. mystax, suponemos que sea muy similar a la de otras especies del género Saguinus (Hershkovitz 1977); la gestación dura 140-150 días y la mayoría de los partos consisten en mellizos dicigóticos.
Tamaño y composición de las camadas
En las tres muestras poblacionales se registró un total de 24 camadas, de las cuales 19 consistían en infantes neonatos y 5 en abortos. El 79% contenía mellizos y el 21% una sola cría; no se observó camadas de trillizos. Esto nos permite estimar que en las poblaciones naturales nacen mellizos en aproximadamente un 80% de los partos.
El hecho que en una muestra total de 69 camadas de infantes mayores y juveniles capturados sólo el 46% tenía 2 crías y el 54% tenía una sola, indica que la tasa de mortalidad infantil - juvenil es bastante elevada en S. mystax.
En una muestra total de 40 camadas de mellizos, la proporción macho/ hembra fue 1:1 (Cuadro 9); lo que nos sugiere que en las poblaciones naturales nacen machos y hembras en una proporción igual. Sin embargo, en la muestra total de 41 camadas de una sola cría hubo una alta preponderancia de machos, siendo la respectiva proporción macho/hembra L0,4 (Cuadro 9). La desproporción fue evidente en las tres muestras poblacionales, especialmente entre los juveniles mayores, y es probablemente debido a una mayor mortalidad entre las hembras juveniles que entre los machos de la misma. edad.
Cuadro 9 .- Composición de las camadas de neonatos, infantes y juveniles capturados en Manití Tahuayo y Tapiche. (M = machos; H = hembras).
|
|
Camadas de 1 individuo |
Camadas de mellizos |
||||||
|
M |
H |
M: |
H |
MM |
MH |
HH |
M: H |
|
|
2 | 2 | 01:00 | 1 | 3 | 4 | 1 | 1: 0,60 |
|
27 | 10 | 01:00 | 0,37 | 8 | 14 | 10 | 1: 1,13 |
|
29 | 12 | 01:00 | 0,41 | 11 | 18 | 11 | 01:01 |
Distribución temporal de los nacimientos
El examen dentario de todos los infantes y juveniles capturados en el Manití (Los Angeles ), Tahuayo y Tapiche permitió determinar el probable mes de nacimiento de cada uno de ellos. La Fig. 10 muestra la distribución por meses de los nacimientos de las respectivas camadas. La distribución demuestra la existencia de una temporada principal de nacimientos (denominada en este informe "Ia temporada de nacimientos") que empieza en Noviembre y se extiende hasta Febrero, alcanzando su máxima intensidad en Enero. Esto es corroborado por la distribución temporal de las observaciones de camadas recién nacidas en el transcurso de los períodos de captura y estudio en las cuencas ya mencionadas, las que están resumidas en el Cuadro 10.
Cuadro 10 .- Distribución mensual de
las camadas de neonatos o de crías de y muy corta edad (menos de 1 mes)
observadas en el campo durante los períodos de captura y estudio en Manití,
Tahuayo y Tapiche.
|
Jun. |
Jul. |
Ago. |
Set. |
Oct. |
Nov. |
Dic. |
Ene. |
Feb. |
|
| Manití | 0 | 0 | 0 | 1 | 4 | 6 | |||
| Tahuayo | 0 | 0 | 0 | 1 | |||||
| Tapiche | 0 | 0 | 2 | 0 | 0 | ||||
| Todos | 0 | 0 | 2 | 0 | 1 | 0 | 1 | 4 | 6 |
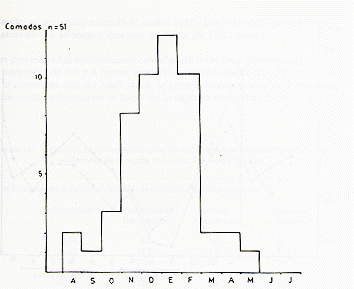
Fig. 10. - La distribución mensual
de los nacimientos de las camadas de infantes y juveniles, capturadas
y examinadas en las poblaciones de Manití, Tahuayo y Tapiche.
Siendo el período de gestación 140-150
días, la gran mayoría de las concepciones efectivas, es decir,
las que contribuyen con infantes y juveniles a la población, ocurren
en la temporada julio-Setiembre. No obstante, la existencia de algunas camadas
nacidas fuera de la temporada de nacimientos y la presencia de hembras preñadas
en todas las muestras mensuales capturadas, salvo en la de Febrero, indica que
las concepciones no están limitadasa aquella temporada sino aparentemente
pueden ocurrir en cualquier época del año. Sin embargo, el hecho
que en la muestra de 64 hembras adultas examinadas en Tapiche y Tahuayo, entre
Junio y Setiembre, sólo el 22% estaban preñadas, mientras que
en la muestra examinada en Octubre (n=23) el 39% estaban preñadas, nos
indica que, en efecto, la incidencia de concepciones se aumenta en la temporada
Julio-Setiembre.(Se estima que la preñez era detectable, con el método
de palpación externa, recién a partir del 2do. o inicios del 3-
mes de gestación.)
Como se puede observar en la Fig. 11, el ciclo reproductivo de S. mystax está nítidamente correlacionado con el régimen de la pluviosidad y con la concomitante fluctuación de la abundancia de los recursos alimentarios; la temporada de nacimientos coincide con el comienzo de la época de mayor
abundancia de frutos y posiblemente de insectos. En conclusión, la existencia
de una marcada temporada principal de nacimientos en S. mystax es probablemente el resultado combinado de un aumento en la tasa de concepciones en Julio-Setiembre y una reducción en la mortalidad infantil entre las crías nacidas en Noviembre-Febrero.

Fig. 11. - La relación entre el
patrón anual de precipitaci´n y el ciclo reproductivo anual de
S. mystax.
Los datos de la precipitación fueron tomados de ONERN (1975); la linea
continua corresponde a la precipitación
registrada en Requena (1964 - 72) y la línea intermitente a la registrada
en Tamshiyacu (1965 - 72)
Los intervalos entre nacimientos
En las manadas que contenían una camada de juveniles seguida por otra de infantes, los intervalos de edad, estimados mediante el examen dentario, variaban de 5,5 a 13,5 meses, con una mediana de 8-9 meses. Sin embargo,
el hecho que la gran mayoría de las manadas reproductivas contenían sólo una camada de descendientes menores de 1 año de edad, sugiere que el intervalo modal entre los nacimientos de sucesivas camadas sería más bien de 12 meses o aún más. Para indagar más sobre este particular, estimamos los intervalos entre 2 sucesivas concepciones en las manadas que contenían una camada de infantes o juveniles y cuya hembra reproductora estaba
gestando su siguiente carnada (Cuadro 11)**. Los intervalos así obtenidos variaron de 8 a 14 meses, con una mediana de 11-12 meses.
En dos manadas encontramos carnadas de infantes y juveniles separados por intervalos de 5,5 y 6 meses, respectivamente (Cuadro 11). Sin embargo, por lo menos en uno de estos casos, la presencia simultánea de 2 manadas mutuamente amistosas en el lugar de la captura motivó duda sobre el verdadero parentesco de estas camadas. En cualquiera de los casos, de acuerdo con los datos disponibles, intervalos menores de 8-9 meses entre nacimientos de sucesivas camadas son relativamente infrecuentes en las poblaciones naturales de S. mystax.
La infrecuencia de intervalos menores de 8-9 meses y el hecho de que ninguna de las 14 hembras capturadas en lactancia estaba preñada, indicaría que, por regla general, en las poblaciones naturales las hembras en lactancia no ovulan.
Cuadro 11 .- Estimación de los intervalos
entre los nacimientos de sucesivas carnadas en las poblaciones de S. mystax
de Manití, Tahuayo y Tapiche. a) Las manadas con 2 sucesivas
carnadas de juveniles e infantes presentes
|
No. |
Fecha examen |
Edad estimada |
(meses) |
Intervalo |
| T11 | 12.08 | 8,8 | 0,0 | 9 |
| M15 | 6.1 | 11,3 | 5,8 | 51/2 |
| M50 | 7.01 | 10,8 | 0,5 | 10-11 |
| M57 | 29.12 | 11,5 | 5,5 | 6 |
| M64 | 2.02 | 12,0 | 34 | 08-09 |
| M67 | 31.03 | 13,7 | 0,0 | 131/2 |
| M78 | 25.02 | 11,0 | 3,0 | 08-Sep |
b) Las manadas con juveniles presentes y la hembra preñada
|
No. |
Fecha examen |
Edad estimada de |
Fase de |
Intervalo |
| T5 | 30.06 | 7,0 | 11 | 08-Sep |
| T10 | 25.07 | 8,0 | 1 | 10-11 |
| T20 | 27.08 | 9,0 | 1 | 11-12 |
| T25 | 29.09 | 11,0 | 11 | 12-13 |
| T26 | 6.1 | 10,3 | 1 | 13-14 |
| T27 | 6.1 | 10,5 | 1 | 13-14 |
| T28 | 6.1 | 11,0 | 1 | 13-14 |
| B11 | 7.1 | 8,0 | 1 | 10-11 |
| B17 | 11.1 | 8,5 | 1 | 11-12 |
* La correlación aproximada entre las fases de gestación y el avance de la preñez (o edad de los fetos) está dada en el texto.
* Sin embargo, no podemos descartar la posibilidad que, en algunos casos, entre estas concepciones hubiera habido otra(s) concepción(es) que terminaron en resorción de embriones o en abortos espontáneos.
Tasa de reproducción
En una muestra de 26 manadas reproductivas (manadas con una hembra preñada, lactante o post-lactante) capturadas en plena temporada de nacimientos (Diciembre-Febrero), 22 tenían hembras en avanzado estado de preñez o lactando crías recientemente nacidas. En base a esta muestra, podemos estimar que aproximadamente el 85% de las manadas reproductivas se reproducen en cada temporada de nacimientos. La tasa anual de reproducción es probablemente un poco mayor, debido a que algunas camadas nacen fuera de la citada temporada.
El porcentaje de hembras preñadas o con crías lactantes de la población total de hembras adultas capturadas en aquel lapso, fue 42%; lo que nos indicaría que, en cada temporada de nacimientos, un poco menos de la mitad de las hembras adultas existentes en la población reproducen.
Fluctuación temporal de tamaño de los testes
Para indagar sobre una posible fluctuación estacional de la condición reproductiva de los machos, medimos la longitud y el ancho del teste derecho en todos los machos adultos examinados en el Manití (Los Angeles), Tahuayo y Tapiche, y calculamos su volumen aproximado (
Análisis de correlación indicó que, dentro de una población, el volumen testicular de los machos adultos era independiente del peso o longitud corporal).
En el Manití, donde tuvimos la oportunidad de examinar
machos desde la segunda mitad de la temporada principal de concepciones (Setiembre)
hasta el final de la temporada principal de nacimientos (Febrero), los resultados
indicaron que los machos tenían testes significativamente más
grandes en Setiembre-Octubre que en la temporada de nacimientos (t= 2,65; g.1.
72; P < 0,02).
Cuadro 12 .- El tamaño promedio mensual
(mm5 de los testes de los machos adultos de las poblaciones de Tapiche, Tahuayo
y Manití los Angeles).
|
|
Temporada de nacimientos |
|||||||||
|
Jun. |
Jul. |
Ago. |
Set. |
Oct. |
Nov. |
Dic |
Ene. |
Feb. |
X |
|
|
645 | 697 | 663 | 704 | 701 | 671 | ||||
|
(13) | (9) | (21) | (6) | (6) | (56) | ||||
|
729 | 723 | 700 | |||||||
|
(4) | (11) | (19) | |||||||
|
928 | 876 | 764 | 834 | 801 | 669 | 830 | |||
|
(8) | (23) | (7) | (15) | (11) | (10) | (74) | |||
|
0,96 | 1,04 | 1,01 | 1,06 | 1,02 | 0,92 | 1,00 | 0,96 | 0,80 | |
* Tamaño proporcional de los testes. En vista que las dimensiones corporales de los individuos de las tres poblaciones son diferentes, incluyendo el tamaño de los testes, los valores (promedios) mensuales fueron convertidos a proporciones, dividiendo el valor mensual por el valor promedio total de la población (presentado en la última columna); los valores T.P. para Agosto, Setiembre y Octubre son promedios de las correspondientes proporciones mensuales.
El Cuadro 12 muestra los promedios mensuales del tamaño de los testes en las 3 poblaciones estudiadas. El análisis de varianza indicó que las diferencias mensuales en los respectivos promedios dentro de cada población no fueron estadísticamente significativas (P > 0,05). No obstante, los valores proporcionales mensuales de la muestra total (Cuadro 12) parecen indicar que los testes experimentan un aumento del tamaño en Julio y una regresión del tamaño en Noviembre, lo que estaría en sincronización con la postulada temporada principal de concepciones. Asimismo, las medidas tomadas de un macho adulto marcado y capturado repetidamente en el Manití reportaron la siguiente fluctuación en el tamaño de los testes:
| Fecha examen | Tamaño teste derecho |
| 01.10.77 | 1,46 cm3 |
| 13.11.77 | 1,08 cm3 |
| 19.12.77 | 1,30 cm3 |
El estro
En las poblaciones naturales de S. mystax se observan a menudo hembras adultas con la vulva conspicuamente hinchada y dilatada, aparentemente señalando que la hembra está en estro. La comparación del tamaño (longitud + ancho) de las vulvas de aspecto normal con las de aspecto hinchado en las hembras adultas examinadas, indicó que las últimas eran significativamente (P < 0,05) más grandes que las primeras, a saber (X + error estándar):
|
Vulva normal |
Vulva hinchada |
|
|
29,8 + 0,6 (n=46) | 35,2 + 2,0 (n=6) |
|
32,9 + 0,8 (n=24) | 38,9 + 1,1 (n=11) |
|
35,5 + 0,8 (n=44) | 47,5 + 1,4 (n=15) |
Una comparación gráfica del tamaño de vulva con el tamaño de cuerpo (Fig. 12) demuestra que el tamaño de la vulva de las hembras adultas de una población no depende del tamaño, sino de la condición de la vulva. Así, por ejemplo, una hembra adulta capturada 2 veces en Manití presentó los siguientes cambios de condición y tamaño de la vulva:
|
Condición |
Longitud |
ancho |
Indice |
|
|
Normal | 16,5 mm | 14,5 mm. | 31,0 |
|
Algo hinchada | 23,5 mm | 21,0 mm | 44,5 |
La condición de la glándula suprapúbica fluctuaba sincrónicamente con la de la vulva: Las hembras con la vulva de aspecto muy hinchado presentaban un mayor desarrollo y grasosidad de la glándula que las hembras de vulva normal. Así, por ejemplo, el ancho + grosor de la glándula en las hembras del Tapiche y Tahuayo dio los siguientes valores promedios (+ error estándar) para las dos condiciones de la vulva:
|
Vulva normal |
Vulva hinchada |
|
|
5,5 ± 0,6 (n=46) | 11,0 ± 1,1 (n=6) |
|
7,7 + 0,8 (n=24) | 11,9 + 0,7 (n=11) |
En las muestras del Manití sólo el ancho de la glándula fue medido, reportando 8,7 + 0,5 mm para las hembras de vulva normal y 10,5 ± 2,7 mm para las de vulva hinchada.
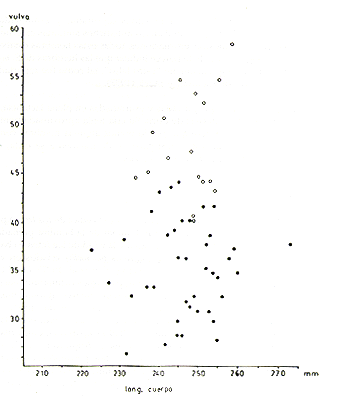
Fig. 12. - Comparaci´n del tamaño
de la vulva (longitud + ancho) con el tamaño (longitud) del cuerpo
en las hembras adultas de S. mystax de Manití (Los Angeles)
La presencia de hembras con la vulva de aspecto hinchado fue observada en todos los meses de captura, salvo en junio; esto fue posiblemente debidoa que sólo 9 hembras adultas fueron examinadas en aquel mes. Los datos disponibles sugieren la existencia de una fluctuación temporal en la proporción de hembras en estro, pero la falta de muestras poblacionales de la temporada Marzo-Mayo y la escasez de muestras de los meses junio, julio, Noviembre y Febrero no nos permiten constatar si la mayoría de las hembras de las poblaciones naturales presentan ciclos de estro durante todo el año.
En una muestra de 23 hembras preñadas capturadas y examinadas en Tahuayo y Tapiche, el 40% presentaban los antedichos síntomas externos del estro. De acuerdo con nuestras estimaciones, todas estas hembras estaban en su 3- o 4to mes de gestación. Esto parece indicar que las hembras de S. mystax experimentan, en plena gestación, un "estro falso", tal como fue reportado en Leontopithecus rosalia por Kleiman y Mack (1977).
Entre las pocas hembras capturadas y examinadas en plena lactancia, sólo una presentaba señales externas de estro. Su cría tenía aproximadamente 1,7 meses de edad, lo que sugiere que por lo menos algunas hembras con cría lactantes experimentan un estro post-partum. Posiblemente se trata, en la mayoría de casos, de un estro no-ovulatorio.
La preñez
En los Callitrícidos, el avance de la gestación (o la edad de los fetos) puede ser estimado mediante palpación transabdominal de la hembra preñada. La correlación entre el diámetro transabdominal y la edad de los fetos ya ha sido determinada para Callithrix jacchus y Saguinus fuscicollis criados en cautividad (Hearn 1977, Phillips y Crist 1975, Gengozian et al. 1977). En el transcurso del examen de los S. mystax capturados, palpamos rutinariamente todas las hembras adultas para averiguar su estado reproductivo; igualmente, examinarnos y medimos sus pezones. En las hembras preñadas medimos el diámetro transabdominal en la forma descrita por Gengozian et al. (1977), salvo en algunas hembras de vientre muy abultado y aparentemente próximas a alumbrar, para no provocar un parto prematuro. Algunas de las hembras dieron posteriormente a luz crías vivas, lo que nos permitió establecer una correlación muy aproximada entre la medida transabdominal y el avance de la preñez en S. mystax. La condición de los pezones también sirvió como indicador del estado reproductivo de la hembra; salvo algunos casos de preñez muy inicial, todas las hembras preñadas tenían los pezones ligeramente enrojecidos y algo o muy turgentes. En las hembras ya próximas a alumbrar, los pezones secretaban un líquido acuoso y de color grisáceo, el hecho observado también en C. jacchus por Phillips y Crist (1975). Nuestras observaciones nos han permitido establecer las siguientes correlaciones aproximadas entre algunas características físicas relacionadas con la preñez y el avance de la gestación:
|
Fase |
Utero |
Ubicación de los fetos |
Diám.transabdominal |
Pezones |
Mes de gestación |
| I |
esférico y |
bajo vientre |
13-28 mm |
nada o poco turgentes |
2° - 3° |
| II |
algo o muy blando |
vientre suprior |
27-30 mm |
turgentes |
3° - 4° |
| III |
blando |
medio vientre o superior |
40(+) mm |
muy turgen 50 |
5° |
Estimamos que nuestro método de palpar no nos permitió detectar la preñez en su fase inicial, sino recién a partir de la segunda mitad del 2do mes, aproximadamente.
Densidad poblacional
La densidad poblacional de S. mystax fue estimada en Los Angeles, Manití, mediante ploteo en mapa de toda la población existente dentro de un área cuadrada de 4 km2 de extensión (Fig. 13). La densidad general así obtenida fue 21,5 individuos de locomoción independiente por km2 (no incluye las crías cargadas). Para estimar la densidad ecológica, es decir la densidad poblacional dentro del hábitat de la especie, descontamos del área total la extensión ocupada por áreas de agricultura y cuerpos de agua, que suman aproximadamente 0,23 km2.
La densidad ecológica resultante fue 23 individuos/km2.El peso total de la población del área censada fue de 43,22 kg, lo que nos da una biomasa ecológica de 11,46 kg/km2.
Exceptuando los casos de monos relativamente sedentarios -tales como Cebuella pygmaea, la densidad poblacional estimada en áreas de hábitat continuo mediante el ploteo de manadas en mapa, generalmente refleja el máximo número de individuos que podrían encontrarse, en un momento dado, dentro de los límites del área censada; esto es debido a que en el ploteo se incluye frecuentemente manadas que ocupan el área sólo marginalmente, resultando una sobreestimación de la verdadera densidad poblacional. Este efecto de los lindes" disminuye a la medida que el tamaño del área de censo es ampliado, sea en término absoluto o en término relativo a la longitud total del área. Como consecuencia de ello, las áreas relativamente grandes y de forma cuadrada (o, idealmente, redonda) dan estimados que más se aproximan a las verdaderas densidades poblacionales. En vista de esto, el estimado obtenido en
Los Angeles probablemente refleja bien la verdadera densidad poblacional en aquella región. Además, las manadas que, según nuestras
observaciones sobre sus movimientos, tenían sus territorios sólo muy marginalmente dentro del área de censo , no fueron incluidas en el cómputo de densidad; y estimamos que más del 70% de las manadas incluidas tenían sus territorios virtualmente completamente dentro del cuadrado censado.
En junio 1976, realizamos un censo general de
S. mystax en la cuenca del Manití, recorriendo un total de 58 km. de
transectos. Para el cálculo de densidad se consideró 60 m como
el campo lateral de detección (30 m para cada lado del transecto).
La densidad obtenida fue de 5 manadas y asociaciones/km2. Un censo de 15,3
km. de transectos en la cuenca del Tahuayo
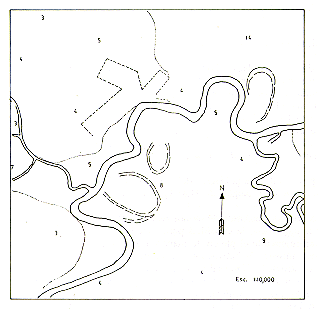
Fig. 13. - Mapa del área de estudio
en Los Angeles Río Manití El cuadrado encierra
de censo, de 4 km2 de extensión. Cada cifra indica la presencia de
una manada de S. mystax y
el máximo número de individuos de locomoción propia observado
en ella; las cifras 9 y 14 señalan
asociaciones mayores, compuestas por dos manadas mutuamente amistosas
(Quebrada Blanco) reportó una densidad ecológica de 6,5 manadas y asociaciones/km2. Censos por transectos efectuados por Aquino en Jenaro Herrera, Río Ucayali (Aquino, este volumen) dieron una densidad de 6,0 manadas/ km.'. Como ya fue indicado, las manadas y asociaciones de S. mystax sufren fluctuaciones temporales de tamaño, siendo el tamaño modal de las mismas para todas las poblaciones estudiadas 5 individuos de locomoción independiente. La conversión de los respectivos resultados en estimados de la densidad ecológica de individuos/km.', en base al tamaño modal de las manadas y asociaciones, nos da las siguientes densidades poblacionales:
|
Manadas/km2 |
Individuos |
|
|
5,0 | 25 |
|
6,5 | 32 |
|
6,0 | 30 |
La densidad estimada para el Tahuayo es probablemente algo exagerada, debido al poco kilometraje censado y al hecho que fue ejecutado únicamente dentro de lo que consideramos el óptimo hábitat de la especie. No obstante, las densidades halladas en las tres áreas son marcadamente similares, indicando que las densidades poblacionales de S. mystax tienden a mantenerse relativamente uniformes a través de su hábitat.
La comparación de las densidades poblacionales obtenidas mediante censos por transectos, con los resultados del censo más detallado que fue hecho en Los Angeles, Manití, parece indicar que el censo por transectos, con el campo auditivo-visual fijado en 60 m, tiende a sobrestimar ligeramente la densidad verdadera de S. mystax; este punto requiere, sin embargo, investigación adicional. A base de los datos disponibles, podemos concluir que, por regla general, la densidad poblacional de la especie en la región es de 20-30 individuos/km2.
Productividad
El número de hembras reproductivas presentes en la población del área censada en Los Angeles fue 15, lo que da una densidad general de 3,75 hembras reproductivas por km2 y densidad ecológica de 3,98/km:2. Estimamos la mortalidad pre-adulta en 40-50 %. Esto, junto con las estadísticas reproductivas ya presentadas, nos permite estimar la tasa de productividad en las poblaciones naturales, de la siguiente manera (a= productividad general; b= productividad ecológica):
|
a) |
b) |
|
|
3,75 |
3,98 |
|
3,19 |
3,38 |
|
5,74 |
6,08 |
|
3,4 |
3,6 |
| (mínima) |
2,9 |
3,0 |
En base a estos cómputos, podemos estimar que, por regla general, la producción de infantes es aproximadamente 6/km2/año y de adultos 3-4/km2/ año.
Conservación y Manejo
Basándonos en los conocimientos adquiridos hasta la fecha sobre la distribución y abundancia de S. mystax, podemos concluir que, aunque la especie tiene una distribución geográfica algo restringida, es relativamente abundante en la región. Las actividades tradicionales de agricultura, extracción forestal y caza no parecen afectar adversamente a los niveles poblacionales de S. mystax; aunque cabe notar que en algunas áreas pobladas la especie es objeto de una limitada caza de subsistencia. Asímismo, debemos señalar que ninguna de las Unidades de Conservación actualmente en existencia en la Amazonía abarca poblaciones naturales de S. mystax.
Bajo un manejo adecuado, la especie constituye
un recurso faunístico apropiado para un limitado aprovechamiento sostenido.
Desde el punto de vista demográfico, las manadas transitorias o incipientes
serían las más indicadas para ser cosechadas; esto estaría
también de acuerdo con las conclusiones teóricas de Heltne (1978)
sobre la estrategia más apropiada de aprovechamiento para los Callitrícidos
en general. Sin embargo, la saca de únicamente manadas transitorias
o incipientes sería, desde el punto de vista operacional, improductiva,
por lo menos en la actualidad, haciendo necesaria la inclusión de manadas
reproductivas en la saca.
Las dos alternativas principales de estrategia de saca serían:
1. Saca selectiva de individuos de todas las manadas.
2. Cosecha de manadas completas (o casi completas), dejando otras manadas completamente intocadas.
En el caso del manejo extensivo de poblaciones naturales, la segunda alternativa sería la más apropiada, ya que no interferiría en la organización social y desenvolvimiento armonioso de las manadas dejadas intactas. Esta alternativa sería también desde el punto de vista operacional la más apropiada.
REFERENCIAS
Aquino, R. (este volumen). La fauna primatológica en áreas de Jenaro Herrera.
Encarnación, F., L. Moya, P. Soini y R. Aquino. (este volumen). Captura de Callitrichidae (Saguinus y Cebuella) en la Amazonía Peruana.
Gengozian, N., J.S. Batson y T.A. Smith.
1977. Breeding of tamarins (Saguinus spp.) in the laboratory. pp 207-213.
En D. G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae.
Smithsonian Inst. Press, Washington, D.C.Hearn,
P. 1977. The endocrinology of reproduction in the common marmoset Callithrix
jacchus. pp. 163-171. En D. G. Kleiman (Ed.). The Biology and Conservation
of the Callitrichidae. Smithsonian Inst. Press, Washington. D.C.
Heltne, P.C. 1978. Demography and wildlife management of tamarins and marmosets. PrimAed. 10: 30-36.
Hershkovitz, P. 1968. Metachromism or the principle of evolutionary change in mammalian tegumentary colors. Evolution 22: 556-575.
Hershkovitz P. 1977. Living New World Monkeys (Platyrrhini). Vol. 1. Univ. Chicago Press, Chicago. xiv + 1117 pp. and Figs.
Kleiman,D.G. y D.S. Mack. 1977. A peak in sexual activity during mid-pregnancy in the golden-lion tamarin, Ueontopithecus rosalia (Primates: Callitrichidae). 1. Mammal. 58: 657-660.
Moya, L., L. Verdi, C. Bocanegra J. Rimachi. (este volumen). Análisis poblacional de Saguinus mystax en la cuenca del Río Yarapa, Loreto, Perú.
Oficina Nacional de Evaluación de Recursos Naturales (ONERN). 1975. Inventario, evaluación e integración de los recursos naturales de la Zona Iquitos, Nauta, Requena y Colonia Angamos. Lima. viii+269pp.
Phillips, I.R. y S.M. Grist. 1975.
The use of transabdominal palpation to determine the course of pregnancy in
the marmoset (Callithrix jacchus). 1. Reprod. Fert. 43: 10310&
Soini, P. 1982. Ecology and population dynamics of the pygmy marmoset, Cebuella
pygmaea. Folia Primatol. 39: 1-21.
Soini, P. (este volumen).
Ecología y dinámica poblacional del pichico común, Saguinus U (Calliffichidae, Primates).
