

FLORA Y VEGETACION DE LA ISLA IQUITOS Y PADRE ISLA (LORETO, PERU): SU RELACION CON EL MANEJO SEMIEXTENSIVO DE Saguinus Mystax, Saimiri sciureus y Aotus
Filomeno Encarnación, Rolando Aquino y Jaime Moro
INTRODUCCIÓN
Estudiar la flora y sus manifestaciones ecológicas en las Islas de Iquitos y Padre Isla, Amazonía Peruana, implica básica y principalmente el conocer e interpretar el origen, la naturaleza y la composición de sus terrenos, porque sobre dichos sustratos prosperará la cobertura vegetal que alberga la fauna silvestre. La estructura y las características del bosque en arcas determinadas, como el de las islas, nos permiten conocer las aptitudes y las tolerancias de las mismas para soportar ciertas presiones de las poblaciones de animales, como en el caso que nos ocupa, de los primates no humanos bajo sistemas de manejo.
Los resultados dé nuestros estudios en un conjunto de islas de reciente formación en la Amazonía Occidental sobre la acción del flujo estacional de las aguas blancas y negras (Sioli 1974), la dinámica de la sucesión vegetal, los factores que favorecen o modifican la sucesión vegetal, entre otras principalmente, serán resumidos en este reporte. La colección botánica, el tratamiento sistemático ortodoxo, son los métodos y procedimientos empleados para explicar las relaciones de la flora y la vegetación con la fauna primatológica.
Caracteres generales de las islas
El conjunto de islas integrado por Padre Isla, Padre Cocha e Isla de Iquitos, está asentado en el Río Amazonas, a 03º 44'S y 73º 14' O, frente a la Ciudad de Iquitos, Perú. Los sucios son de origen aluvial reciente (Marlier 1973, Prance 1979), con fisiografía de "restingas" (Soini, este volumen; Encarnación, este volumen), o sea pequeñas depresiones colindando con terrenos más elevados, atravesada por numerosos cuerpos de agua lénticos o lagos meándricos denominados "cochas", que se comportan como cuerpos de agua netamente lóticos en el período de aumento de caudal llamado "creciente".
La variación estacional del caudal o volumen corresponde a la variación del nivel en los flujos de agua negra en el estiaje y agua blanca en el de "creciente" (Prance 1979, Sioli 1974). La fuerza hidráulica del incremento y disminución del caudal del agua del Río Amazonas (Marlier 1973), determina la bifurcación del cauce matriz en 2 ramales principales y en otro pequeño (Fig. 1; Moya 1983), cuyos cauces son relativamente inestables. La inestabilidad también está manifiesta en el relativo desplazamiento de la superficie del terreno, es decir, erosión vertical por desmoronamiento de masas de tierra en el lado Sur, y la deposición parcial en sentido horizontal en la Zona Norte del conjunto de islas (Fig. D. Igualmente, la subida y bajada del nivel de agua y el consecuente acarreo de partículas y cuerpos sólidos (limo, arcilla, arena y restos vegetales) provocan la eutroficación de los lagos meándricos, así como de los cauces menores del Río Amazonas en el interior de las islas. La eutroficación unida a la deposición de sólidos, facilitan el crecimiento y desarrollo de los vegetales eucariotas (musgos, líquenes, hongos, helechos, monocotiledóneas y dicotiledóneas) en todas sus categorías y rangos morfológicos resumidos en la vegetación herbácea, arbustiva y arbórea; de hábitos acuáticos, terrestres, epífitos, semiparásitos, estranguladores y saprofitos.
Algunas dimensiones
Datos disponibles hasta 1976, permitieron obtener las dimensiones anotadas en el Cuadro 1. Las elevaciones de las restingas son menos de 4 m sobre el nivel más bajo, en el estiaje, de los lagos meándricos interiores y posiblemente menos de 10 m sobre el nivel más bajo, también en estiaje, del caudal del Río Amazonas. Los registros de mayores alturas corresponden a las restingas de la Isla de Iquitos. Otros datos dimensionales están citados por Moya (1983 ), Soini y Moya (este volumen). Considerando las observaciones anotadas al final del Cuadro 1, las dimensiones y la fisiografía de las islas sufren cambios, como consecuencia del efecto hidráulico erosivo y sedimentario-acumulativo del Río Amazonas.
Aspectos de la dinámica geológica y edáfica
Actualmente, la variación del caudal de agua expone a
las islas a constantes cambios y alteraciones en la estructura geológica
y edáfica. Estos cambios son menores en la mayor de las islas (la Isla
de Iquitos). Esta dinámica está en parte determinada por el limo,
arcilla y otros cuerpos sólidos acumulados en delgadas capas sobre los
terrenos sujetos a la inundación estacional. La acumulación de
sedimentos es el resultado de la precipitación, la sedimentación
y la decantación de los sólidos en suspensión en las aguas
blancas, regulada por fuerzas horizontales y verticales que son producidas en
el agua y las partículas sólidas (Fig. 1).
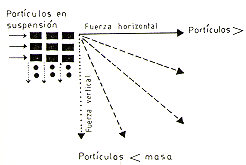
Fig. 1. - Acción de la fuerza hidráulica del Río
Amazonas en la dinámica geológica
y edáfica de las islas.
Cuadro 1.- Dimensiones de Isla de lquitos y
Padre Isla
|
Islas |
Longitud máxima km |
Ancho máximo km |
Area km2 |
Fuente Bibliográfica |
| Isla de Iquitos (incluye Padre Cocha) | 17,8 | 7,7 | 52,7 | Soini (este volumen) |
| Padre Isla* | 5,2 | 4,4 | 14,6 | Soini (este volumen) |
| 5,3 | 3,5 | 8,26 | Moya (1983) |
* En las dimensiones de Padre Isla advertimos disminución del área, éstas pueden representar errores en los cálculos o realmente demuestran los efectos hidrodinárnicos del Río Amazonas.
Los efectos hidráulicos se traducen en la inaparente traslación o desplazamiento del terreno de Sur a Norte. Al mismo tiempo, se originan fuerzas hidráulicas horizontales que comprimen las masas de tierra, produciendo los plegamientos que muchas veces constituyen las restingas. En conjunto, la acumulación de las partículas en suspensión, la fuerza hidráulica de compresión lateral u horizontal, originan las ondulaciones del relieve, en circunstancias aceleradas por la erosión de escorrentía cuando se inicia el estiaje. En esta fase distinguimos las restingas y las depresiones, que en algunos casos definen los lagos ineándricos o cochas (Fig. 2). Las figuras 1 y 2, nos facilitan comprender la relación directa existente entre el caudal estacional del Río Amazonas y la dinámica geológica-edáfica. En los terrenos sujetos a inundación, durante el estiaje, se inician, continúan o se mantienen fases de una sucesión vegetal tendiente a desarrollarse hacia una vegetación clímax; con especies adaptadas al flujo estacional de las aguas blancas o turbias (Sioli 1974), es decir, una forma de vegetación denominada de "tahuampa" (Encarnación, este volumen) o de "várzea" estacional (Prance 1979) en la terminología brasileña.
***********************FALTA ESCANEAR FIG PAG 478**************************************
La flora y la vegetación
El inventario de los taxa vegetales para comprender las asociaciones y comunidades vegetales está aún en proceso. No obstante, en el conjunto de islas, se ha constatado la presencia de sucesiones vegetales desde las monocotiledóneas y dicotiledóneas con especies herbáceas hacia las arbustivas y arbóreas. De éstas, los árboles y arborescentes ofrecen espacios verticales y horizontales, importantes para el manejo semiextensivo de los primates no humanos. Las diferencias y las semejanzas entre los componentes de la flora son del orden estrictamente botánico-sistemático. El conocimiento de las asociaciones y comunidades que aquellos presentan son esenciales para los objetivos del manejo de primates. El Cuadro 2 nos facilita comprender la composición de la vegetación en los bosques de las islas.
Los muestreos de la vegetación fueron efectuados en parcelas de 100 m de largo x 10 m de ancho (Cain et al. 1956), empleando los senderos demarcados para los estudios eco-etológicos de Saguinus y Saimiri. Referente al Cuadro 2, debemos agregar que los ejemplares de Chorisia sp., Ficus insípida, Calycophyllum spruceanum, Clarisia biflora, Hura crepitans, Couroupita amazónica, Piptadenia sp., entre los principales, alcanzan mayores portes y diámetros en la Isla de Iquitos, debido a la mayor edad de las mismas. Esta evidencia asegura la abundancia de lianas, bejucos, epífitas, semiparásitas y otras, que ofrecen hábitats favorables para las actividades nocturnas y diurnas de Aotus y Saimiri, respectivamente, mientras que Padre Isla aún no reúne similares condiciones.
Factores que favorecen o modifican la sucesión vegetal en las islas
La vegetación isleña está expuesta a permanentes cambios, desde la vegetación herbáceo-graminosa en el lado Norte, hacia la estabilización en un bosque inundable estacional (en Padre Isla) o no inundable (en la Isla de Iquitos), conformada principalmente por dicotiledóneas. Cada fase de esta sucesión, podemos involucrarla en el concepto de vegetación clímax. Estos aspectos se discuten en otro documento (Encarnación, en redacción). Sin embargo, en el ecosistema de dichas fases, tenemos que remarcar algunos factores que están presentes y que favorecen o modifican el ritmo de la sucesión vegetal. Entre éstos, discutiremos: el hombre, los insectos y los y las aves.
Cuadro 2.- Especies representativas de los
bosques de la Isla de Iquitos y Padre Isla.
|
Taxa |
Nombre vernáculo |
Forma vegetal |
Hábitat |
Abundancia* | |
|
Isla Iquitos |
Padre Isla |
||||
| 1. Menores de 5 m de alto: árboles, arbustos, lianas, bejucos, epifítas, semiparásitas y hierbas. | |||||
|
Monocotiledóneas |
|||||
|
Araceae |
|||||
|
Montríchardia aff. linifera |
raya blanca |
hs |
H |
4 |
3 |
|
Monstera obliqua |
hs |
e |
2 | 1 | |
|
Pistia stratiotes |
guama |
hs |
H |
3 | 3 |
|
Dioscoreaceae stegelmanniana |
Dioscorea |
h |
t |
3 | 3 |
|
Gramineae |
gramalote |
h |
H-sH |
4 |
4 |
|
Hymenachne amplexicaule |
gramalote |
h |
sH |
4 |
3 |
|
Gynerium sagittatum |
caña brava |
hl |
t-sH |
2 |
3 |
|
Oryza grandiglumis |
arrocillo |
h |
sH |
3 |
2 |
|
Paspalum repens |
h |
H |
2 |
2 |
|
|
Musaceae |
|||||
|
Heliconia episcopalis |
shitulli |
h |
t |
4 | 3 |
|
Heliconia marginata |
shitulli |
h |
t |
4 |
3 |
|
Palmae |
|||||
|
Bactris sp. |
ñejilla |
st |
t |
4 |
3 |
|
Phytelephas aff macrocarpa |
yaina |
st |
t |
3 |
2 |
|
Dicotiledóneas Acanthaceae |
|||||
|
Justicia pectoralis |
h |
t |
4 |
3 |
|
|
Amaranthaceae |
|||||
|
Althernanthera fícoides |
h |
t |
4 | 3 | |
|
Annonaceae |
|||||
|
Rollinia sp. |
sacha chirimoya |
a |
t |
3 | 2 |
|
Xylopia sp. |
sacha chirimoya |
a |
t |
3 |
3 |
|
Bignoniaceae |
|||||
|
Crescentia amazoníca |
yacu huingo |
a |
r |
3 |
3 |
|
Capparidaceae |
tamara del bajo |
a-A |
r |
3 |
3 |
|
Chrysobalanaceae |
|||||
|
Couepia ulei |
parinari |
a-A |
r |
3 |
3 |
|
Combretaceae |
|||||
|
Combretum rotundifolia |
b |
f |
2 | 2 | |
|
Buchenavía oxycaria |
yacushapana |
a-A |
f |
2 |
2 |
|
Compositae |
|||||
|
Clíbadium sp. |
sacha huaca |
a | t | 3 | 2 |
|
Eclípta alba |
h | t | 3 | 3 | |
|
Mikania congesta |
h | sH | 3 | 3 | |
|
Cucurbitaceae |
|||||
|
Cayaponia granatensis |
h |
t |
3 |
3 |
|
|
Fevillea cordifolía |
h |
t |
3 |
2 |
|
|
Gurania spp. (2 especies) |
h |
t |
3 |
2 |
|
|
Luffa operculata |
h |
t |
3 |
2 |
|
|
Euphorbiaceae |
|||||
|
Acalypha scandens |
b | t | 2 | 2 | |
|
Acalypha spp. (3 especies) |
a | t | 2 | 2 | |
|
Alchornea spp. (3 especies) |
a | t | 3 | 3 | |
|
Flacourtiaceae |
|||||
|
Banara nitida |
a |
t |
2 |
2 | |
|
Casearia aff. javitensis |
a |
t |
2 |
2 | |
|
Laetía corymbulosa |
a |
t |
2 |
2 | |
|
Cuttiferae |
|||||
| Clusia spp. (3 especies) | renaco | a | e | 3 | 2 |
| eguminosae | |||||
|
Andira inermis |
b |
e |
2 |
2 |
|
|
Cassia reticulata |
retamilla | a | t | 2 | 2 |
|
Dioclea dictyoneufa |
a | t | 3 | 2 | |
|
Loganiaceae |
|||||
|
Strychnos spp. (3 especies) |
b | t | 3 | 2 | |
|
Loranthaceae |
|||||
|
Phoradendron piperoides |
pishjomicuna |
a |
sp |
4 |
3 |
|
Psittacanthus cucularis |
pishjomicuna |
a |
sp |
4 |
3 |
|
Passifioraceae |
|||||
|
Passiflora coccinea |
granadilla |
b-1 |
t-r |
3 |
2 |
|
Passiflora pytrantha |
b-1 |
t |
2 |
2 |
|
|
Passiflora quadriglandulosa |
granadilla |
b-1 |
t |
3 |
3 |
|
Vitaceae |
|||||
|
Cissus erosa |
1 |
t |
3 | 2 | |
|
Cissus sicyoides |
1 |
t |
3 | 2 | |
|
2. Mayores de 5 m de alto: Arboles, arbustos |
|||||
|
Monocotiledóneas |
|||||
|
Palmae |
|||||
|
Astrocaryum sp. |
huiririma |
st |
r-t |
3 |
2 |
|
Euterpe precatoria |
chonta |
st |
t |
3 |
2 |
|
Scheelea cephalotes |
shapaja |
st |
t |
2 |
- |
|
Dicotiledóneas |
|||||
|
Anacardiaceae |
|||||
|
Spondias lutea |
ubos |
A |
t |
2 C |
2 C |
|
Annonacea |
|||||
|
Anaxagorea sp. |
espintana |
A(em) |
t |
1 |
3 |
|
Bombacaceae |
|||||
|
Chorisia sp. |
lupuna |
A(em) |
t |
1 |
- |
|
Pachira aquatica |
punga |
A |
r-sH |
2 |
3 |
|
Eleaocarpaceae |
|||||
|
Muntingia calabura |
yumanasa |
A-a |
t |
3 |
3 |
|
Sloanea sp. |
cepanchina |
A |
t |
3 |
3 |
|
Euphorbiaceae |
|||||
|
Hura crepitans |
catahua |
A(em) |
t |
3 |
1 |
|
Sapium sp. |
caucho masha |
A |
t |
3 |
2 |
|
Flacourtiaceae |
|||||
|
Laetia aff. procera |
temarehua |
A |
t |
3 |
4 |
|
Guttiferae |
|||||
|
Rheedia acuminata |
charichuelo |
A |
t |
3 C |
1 C |
|
Rheedia longífolía |
charichuelo |
A |
t |
3 C |
2 C |
|
Lauraceae |
|||||
|
Aniba sp. |
moena |
A |
t |
3 |
3 |
|
Nectandra sp. |
moena |
A |
t |
3 |
3 |
|
Lecythidaceae |
|||||
|
Couroupita amazonica |
ayahuma |
A(em) |
t-r |
3 |
1 |
|
Eschweilera sp. |
machimango |
A |
t |
3 |
- |
|
Leguminosae |
|||||
|
Erythrina glauca |
amasisa |
Ama |
&E |
1 |
|
|
Inga sp. (especie 1) |
shimbillo |
A-a |
t |
2 | 3 |
|
Inga sp. (especie 2) |
shimbllo |
A-a |
t |
2 |
4 |
|
Inga edulis |
guava |
A |
t |
2 C |
4C |
|
Inga ingoides |
guava |
A |
t |
2 C |
2 C |
|
Piptadenia sp. |
Pashaco |
A(em) |
t |
3 |
4 |
|
Meliaceae |
|||||
|
Cedrela aff. fissilis |
cedro |
A |
1 |
2 |
1 |
|
Guarea glabra |
requia |
A |
t |
3 | 3 |
|
Guarea sp. |
requia |
A |
t |
3 | 3 |
|
Moraceae |
|||||
|
Artocarpus altilis |
árbol del pan |
A |
t |
21C | 31C |
|
Cecropia aff. latiloba |
cetico |
A |
t-r |
3 | 3 |
|
ChIorophora tinctoria |
insira |
A |
t-r |
2 | 3 |
|
Clarisia biflora |
capinuri |
A(em) |
t |
3 | 3 |
|
Ficus insipida |
Ojé |
A(em) |
t-r |
3 | 3 |
|
Naucleopsís glabra |
tamamuri |
A |
t |
2 | - |
|
Myristicaceae |
|||||
|
Iryanthera sp. |
cumala |
A | t |
2 |
2 |
|
Rubiaceae |
|||||
|
Calycophyllum spruceanum |
capirona |
A(em) |
t-r |
3 |
4 |
|
Cenipa americana |
huito |
A |
t |
2C |
3C |
|
Violaceae |
|||||
|
Leonia glycycarpa |
tamara de altura |
A-a |
t-r |
3 |
1 |
|
3. Especies cultivadas |
|||||
|
Monocotiledóneas |
|||||
|
Gramineae |
|||||
|
Oryza sativa |
arroz |
h |
t-H |
||
|
Saccharum officinarum |
caña de azúcar |
hi |
t |
||
|
zea mays |
maíz |
h |
t |
||
|
Marantaceae |
|||||
|
Calathea sp. |
bijau |
h |
t | ||
|
Musaceae |
|||||
|
Musa aff. paradisiaca |
plátano |
h |
t |
||
|
Musa sp. |
plátano |
h |
t |
||
|
Dicotiledóneas |
|||||
|
Bombacaceae |
|||||
|
Quararibea cordata |
sapote |
A |
t |
||
|
Chrysobalanaceae |
|||||
|
Couepia aff. subcordata |
parinari |
A |
t |
||
|
Cucurbitaceae |
|||||
|
Citrullus Vulgaris |
sandía |
h |
t |
||
|
Leguminosae |
|||||
|
Phaseolus sp. |
frejol |
h |
t |
||
|
Vigna aff. sinensis |
chiclayo |
h |
t |
||
|
Moraceae |
|||||
|
Pourouma cecropiefolia |
uvilla |
A |
t |
||
|
Myrtaceae |
|||||
|
Eugenia jambolanum |
aceituna |
A |
t |
||
|
Syzygium rnalacenses |
poma rosa |
A |
t |
||
|
Sapotaceae |
|||||
|
Lucuma sp. |
calmito |
A |
t |
||
|
* Abundancia relativa en un transecto de 1OOm de largo x 10 m de ancho. |
|
|
Forma vegetal. |
|
|
A Arbol |
|
|
(em) |
Ernergentoe~ mayor de 25 m de alto. |
|
a |
Arbusto |
|
b |
Bejuco |
|
h |
Lherba |
|
hl |
Lfierba leflosa (caña) |
|
hs |
1 fierba suculenta |
|
1 |
Lana |
|
st |
Estípite, fuste de las palmeras |
|
Hábitat. |
|
|
e |
Epifíta |
|
H |
Hidrofita propiamente acuática |
| r | Ripana, que habita en orillas de lagos y ríos |
|
sH |
Sernihidrófita, propiamente semíacuática |
|
sp |
Semiparásita |
|
t |
Terrestre |
|
Relaciones con las actividades humanas |
|
|
C |
Cultivadas pero también se hallan en el bosque |
|
IC |
Introducidas y cultivadas, llamadas naturalizadas. |
El hombre.
Mediante la implantación de monocultivos, tales como arroz, frejoles y chiclayos, en las playas del lado Norte; de plátanos, yucas y frutales en los terrenos interiores con capas aluviales que aparecen en el estiaje. Estas prácticas favorecen la invasión selectiva de especies que se comportan como malezas, que al terminar las cosechas, serán las pioneras en la ocupación de las nuevas áreas.
La práctica de la agricultura migratoria de rozo-tala-quema, disturba la sucesión vegetal con las más drásticas y severas consecuencias, como la erosión del suelo por escorrentía de lluvias, caída de los árboles colindantes por interrupción de las cortinas para el viento, depredación de semillas y simientes (plántulas) por los insectos, las aves y diversos mamíferos. Igualmente, la introducción de especies exóticas y extrañas al hábitat sucesional, como frutales y otras, modifican la sucesión o regeneración de los bosques. Debemos hacer notar que en el Plan de Manejo de Fauna Silvestre de las Islas (Heltne et al. 1980) están contemplados los efectos del factor humano. Actualmente, se propende a la introducción de nuevos cultivos y al manejo del bosque que consiste en la aplicación de diversas alternativas que favorecen a la población humana allí asentada, así como a las poblaciones de primates no humanos.
Los insectos.
Conocemos la función benéfica de ciertos ortópteros, himenópteros y coleópteros en la polinización. Estudios de esta índole serán enfatizados en las islas. Sin embargo, entre las interrelaciones también se presentan efectos de depredación de yemas foliares y florales, flores, frutos, semillas y simientes, que también tomará interés próximamente. La función ecológica de una hormiga defoliadora, con nido arborícola, es importante en la formación de suelo orgánico en la isla, favoreciendo además la dispersión de semillas y la prosperidad de las simientes.
Mamíferos voladores y aves.
Murciélagos frugívoros del género Artibeus se alimentan de frutos de Clarisia biflora, Ficus insipida, Chlorophora tinctoria y otros Ficus. Estos murciélagos transportan los frutos hacia los senderos, dejando caer las semillas en pequeños montículos, deviniendo la germinación a manera de almácigos de trecho en trecho y alineados, con beneficios para la sucesión vegetales.
Dos aves migratorias, Tyrannus tyrannus y Muscivora tyrannus (Tyrannidae), conocidos como "Copayos", habitan las islas de Febrero hasta Abril. Estas aves durante el día frecuentan los bosques altos interiores, para alimentarse de las drupas dehiscentes de Laetia aff. procera "temarchua" (Flacourtiaceaea), pernoctando entre las comunidades de Gynerium sagittatum (Gramineae), denominados "cañaverales", de las playas y riberas, porque defecan las semillas no digeridas, contribuyendo así en la dispersión. La germinación que sigue a este fenómeno, representa la reforestación natural en líneas paralelas de plantones que logramos diferenciarlas en estratos o galerías, que corresponden a la migración estacional de las aves y a la presencia de nuevas áreas de terrenos (denominados playas o barriales) ocupadas por Gynerium.
Las colonias de primates sometidas al manejo en las islas
La Isla de Iquitos, por su extensión, su diversidad florística nativa e introducida, la relativa madurez de sus bosques (posiblemente 80 años) y con fisionomía y arquitectura de la vegetación arbórea definida para cada especie, ofrece hábitat adecuado para ser habitada por Saimiri y Aotus. Las poblaciones actualmente presentes han establecido interacciones o competencia con el hombre por los cultivos de frutales. Saimiri manifiesta plasticidad en su adaptación alimenticia, debido a su dieta omnívora (Encarnación, este volumen); ellos invaden plantaciones de Zea mays (maíz), Vigna aff. sinensis (chiclayo), Naseolus sp. (frijol), Citrullus vulgaris (sandía), Musa spp. (plátano) y otros frutales. Esta sinergia de consumo y competencia entre primates humanos y no humanos, se intensifica en los meses de Octubre a Enero, que corresponden a los más críticos de la escasez de frutos silvestres.
En Padre Isla, el proceso de ocupación de territorios por las manadas de Saguinus mystax está siendo actualmente estudiado. Debido a la extensión relativamente reducida de bosque alto y relativa escasez de árboles adecuados para el normal desplazamiento, el ambiente de la isla no ofrecía a las manadas introducidas un hábitat óptimo.
Saguinus mystax, otro representante omnívoro entre los primates, también manifiesta cierta plasticidad en su adaptación alimenticia progresiva. El Cuadro 3 presenta una lista de especies que la población introducida a la isla ha incorporado en su dieta, incluyendo algunas especies que no forman parte de la dieta en su hábitat natural. Frutos de las especies de Ficus y exudado de Piptadenia también consumen en su hábitat natural.
En esta isla, Calycophyllum spruceanum (capirona) y Ficus insipida (ojé) son muy abundantes y las especies dominantes en cuanto a altura y área basal, es decir, son árboles emergentes con alturas mayores de 35 m; sin embargo, no favorecen a la población de S. mystax por las siguientes razones:
- Calycophyllum, con copa emergente y aplanada, ramificación casi vertical o erguida, corteza lisa, follaje en las ramitas terminales; por estas características no ofrece protección de los eventuales depredadores ni alberga epífitas o lianas.
- Ficus, con copa difusa, follaje disperso, ramificación arqueado-vertical; tampoco alberga epífitas ni ofrece refugio de los depredadores.
CONCLUSIONES
El aumento y la disminución del caudal del Río Amazonas desarrollan fuerzas hidráulicas que alteran la geología y edafología de las islas, motivando la traslación inaparente del terreno, desaparición en el sector Sur y formación de nuevas áreas en el sector Norte.
La fuerza hidráulica induce la eutroficación de los lagos meándricos en el interior de las islas y de los ramales menores del Río Amazonas. La ejecución de programas de manejo y mantenimiento de los cuerpos de agua para el aprovechamiento integrado es importante, por ejemplo, instalar piscigranjas (o someter al dragado el ranial Caro Cocha) (Moya 1983) para detener la fusión de ambas islas.
La flora y la vegetación de la Isla de Iquitos reúnen características dé hábitats favorables para las poblaciones de Saimiri y Aotus. En Padre Isla es necesario incrementar el espacio vertical y horizontal arbóreo disponible para S. mystax. Esta necesidad está contemplada en el Plan de Manejo de Islas (Heltne et al. 1980).
Saimiri, Aotus y Saguinus son primates omnívoros, que manifiestan plasticidad en su adaptación. Como resultado aprenden a comer algunos frutos y otras partes vegetales que no hallan en sus hábitats naturales.
REFERENCIAS
Cain, S.A., C.M. de Oliveira Castro, J. Murca Pires y N. T. Da-Silva. 1956. Application of some phytosociological techniques to Brazilian Rain Forest. Am. J. Bot. 43:911- Encarnación, F. (este volumen). Aspectos de la adaptación de Saimiri sciureus Linnaeus, "Fraile" (Primates: Cebidae) a nuevas fuentes alimenticias en la Amazonía Peruana.
Heitne, P.C., L. Moya, R. Rufz, J. Moro y C. Málaga. 1980. Plan de Manejo de Fauna Silvestre en Semicautiverio en la Isla de Iquitos y Padre Isla. Dir. Reg. Minist. Agr. y Aliment. - IVITA-OPS, Iquitos, Perú.
Marlier, C. 1973. Limnology of the Congo and Amazon Rivers. pp. 223-238. En B.E. Meggers, E.S. Atensu y W.D. Duckworth (Eds.). Tropical Forest Ecosystems in Africa and South America. A Comparative Review. Smithsonian Institution Press, Washington, D.C.
Moya, L. 1983. Algunos resultados sobre el manejo de la fauna silvestre en semicautiverio en la Isla de Iquitos y Padre Isla, Loreto, Perú. Simposio sobre Primatología en Latinoamérica, IX Congreso Latinoamericano de Zoología. Arequipa, Perú.
Prance, G.T. 1979. Notes on the vegetation of Amazonia. III. The Terminology of Amazon Forest Types subjetc to inundation. Brittonia 31: 26-38.
Sioli, 1974. Tropical rivers as expressions of their terrestrial environments. pp. 275-288. En F.B. Colley y E. Medina (Eds.). Tropical Ecological Systems. Trends in Terrestrial and Aquatic Research. Springer Verlag, New York.
Soini, P. y L. Moya. (este volumen). Informe sobre los resultados de los estudios primatológicos en la Zona Norte de la Isla de Iquitos.
Soini, P. (este volumen). Informe de los resultados de una
investigación preliminar de la fauna de la Isla de Iquitos e islas adyacentes.
ESTUDIO DE LA BIOECOLOGIA DE Saimiri sciureus EN LA ISLA DE IQUITOS, LORETO, PERU*
(* Compendio de la Tesis para optar el Título de Biólogo, Universidad Nacional de la Amazonía Peruana,I quitos, Perú, 1984).
Carlos Ique
INTRODUCCIÓN
De los estudios efectuados en Saimiri, la mayoría corresponde a los de laboratorio (Rosenblum 1968, Dunn 1968, Smith et al. 1983). Los estudios en áreas naturales son pocos, destacando el de Baldwin y Baldwin (1971, 1972), Fleagle et al. (1981), Encarnación (este volumen), Soini (este volumen) y Soini y Moya (este volumen). La escasa información motivó la realización del presente estudio, a fin de incrementar las investigaciones ecológicas.
Los objetivos del presente estudio fueron: 1) Determinar taxonómicamente la población de Saimiri, 2) obtener datos sobre tamaño y composición por edad y sexo de las manadas, 3) determinar la densidad poblacional, y 4) lograr información sobre reproducción, comportamiento y alimentación.
DESCRIPCIÓN DEL ÁREA DE ESTUDIO
La Isla de Iquitos con una extensión aproximada de 52,7
km2, está ubicada en el Río Amazonas, frente a la Ciudad de Iquitos,
(03'45'5 y 73'14'0) y a 106 m.s.n.m. (Fig. l). Ecológicamente corresponde
a la eco-zoorregión de Selva Baja (Brack 1975) o Bosque Húmedo
Tropical transicional a Bosque muy Húmedo Tropical (QNERN 1976). Esta
isla de origen aluvial, posee numerosos lagos longitudinales que discurren de
Oeste a Este, separados por fajas de terrenos relativamente altos, denominadas
"restingas". En época de creciente (Diciembre-Mayo), las áreas
hoscosas son inundadas temporalmente por masas de agua blanca. El bosque varía
desde muy heterogéneo a homogéneo, cuyos árboles en algunos
casos alcanzan 40 m de alto. Entre las especies forestales destacan Callycophyllum
sp., Clarisia sp., Ceiba sp., Chorisia sp., Inga spp., y Spondias mombin.
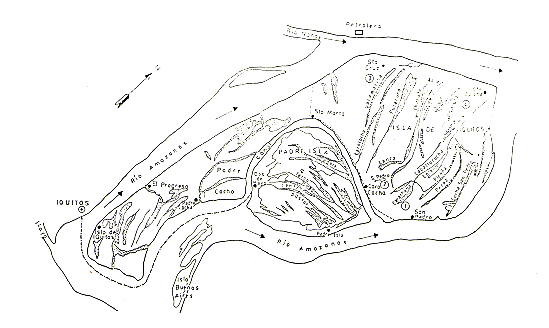
Fig.1. - Mapa de la Isla de Iquitos
1.... 4: Areas de estudio
MATERIALES Y MÉTODOS
El estudio se realizó al Norte de la Isla de Iquitos, desde Setiembre 1982 a Noviembre 1983. Comprendieron cuatro áreas de estudio, cada una con aproximadamente 2 km? de extensión.
Para la ubicación y observación de las manadas, se abrieron 35,4 km de trochas que fueron señaladas cada 100 m con placas de aluminio. Cada placa fue. rotulada convenientemente con 2 números, donde el primero indicaba la trocha y el segundo multiplicado por 100, la distancia en metros en la trocha.,
Para los censos se utilizó el método de transecto descrito por Freese (1975). Los censos fueron conducidos alternadamente bajo dos horarios (un día era de 04:30 a 09:30 h y de 11:30 a 15:30 h; al día siguiente de 09:30 a 11:30 h y de 15:30 a 18:30 h). Las manadas censadas fueron graficadas en el mapa base, a escala de 1:10 000.
Para el atrapamiento de los animales se utilizaron trampas de malla metálica galvanizada, con dimensiones de 1 x 1 x 2 m y una pulgada de cocada. La puerta de acceso con dimensiones 0,1 x 0,25 m estuvo ubicada (m la, parte superior de la trampa y conectada a un cordel de nylon No. 16 para facilitar el cerrado de la puerta al momento de atrapar a los animales. Los animales atrapados fueron anestesiados vía intramuscular con Clorhidrato de Ketamina, a una dosis de 10 mg/kg de peso corporal. Después de la toma de medidas morfométricas, se efectuó el marcaje y tatuaje para diferenciar una manada de otra. Pasado el efecto del anestésico, los animales fueron liberados en el mismo lugar de captura.
Para la identificación taxonómica se sacrificaron 10 ejemplares, cuyas pieles fueron preparadas y enviadas al Dr. P. Hershkovitz del Field Museum of Natural History de Chicago. También se colectaron muestras botánicas (ramas y frutos) de las plantas utilizadas por Saimiri en su alimentación. Asimismo, los árboles de dormir fueron señalados con pintura y cintas plásticas de color para su identificación posterior.
La correlación peso-longitud total de 63
ejemplares, donde estuvieron incluidos los diferentes niveles de edad, . fue
estimada mediante el cálculo del valor "r" (Sokal y RohIf 1979).
RESULTADOS Y DISCUSIÓN
Comprobación taxonómica
De acuerdo a la descripción efectuada por Hershkovitz (1984) para el género Saimiri, y basada en la identificación de las 10 muestras, se comprueba que la población en la Isla de Iquitos pertenece a Saimiri sciureus macrodon Elliot 1907, comúnmente llamado fraile arco gótico". Esta especie se caracteriza por presentar una banda blanquecina amplia por encima de los arcos superciliares, vibrisas supraorbitales laterales en mechones; superficie de la corona grisácea; orejas empenachadas; dorso y lados del tronco, extremidades anteriores y posteriores anteados o grisáceos; cola larga terminada en un mechón de pelos largos y de color negro. La longitud total promedio en machos adultos fue de 718,5 mm y peso 840 g, mientras que en las hembras 625 mm. y 697,5 g, respectivamente. Esta comprobación esclareció las apreciaciones de Soini (este volumen), y Soini y Moya (este volumen), quienes sostenían que en la Isla de Iquitos, además de Saimiri sciureus macrodon, existían uno o dos grupos de Saimiri boliviensis peruviensis (su S. sciureus nigriceps).
Correlación peso-longitud
El análisis de correlación peso-longitud total en base a 63 ejemplares (Cuadro l), indica que la correlación (r) entre parámetros, tanto en machos, hembras y ambos sexos combinados, presenta valores positivos que son significativos. Así en machos r = 0,846177 (P4,05 y 27 G.L.); hembras r = 0,~96 (P<0,05 y 32 G.L.) y ambos sexos r = 0,853039 (P4,05 y 61 G.L.). Las Figs. 2, 3 y 4 presentan los gráficos de las respectivas correlaciones.
Ecología
El hábitat preferencial de Saimiri en la Isla de Iquitos son los bosques cercanos a los canales, lagunas y terrenos de cultivo abandonados. Las preferencias observadas en la isla están en concordancia con Baldwin y Baldwin (1971) y Fleagle et al. (1981), quienes sostienen que estos animales tienden a ubicarse tanto en bosques vírgenes como secundarios y cercanos a las masas de agua, o rodeados por tierras cultivadas o de pastoreo, donde preferentemente utilizan el estrato medio del bosque. En la época de creciente de los ríos (Diciembre-Mayo) se observó que los Saimiri tienden a frecuentar las áreas boscosas inundadas o cerca de ellas, donde existen más árboles en fructificación. En días de lluvia o sombríos, éstos tienden a desplazarse por los estratos más altos del bosque, mientras que en días de sol se movilizan por los estratos inferiores.
Cuadro 1.- Tamaño de las manadas de S. s. macrodon en las 4 áreas de Estudio en la Isla de Iquitos
|
Lugar |
Manada No. |
No de Animales |
| San Pedro | 1 | 23 |
| " | 2 | 22 |
| " | 3 | 27 |
| " | 4 | 25 |
| " | 5 | 18 |
| " | 6 | 13 |
| " | 7 | 15 |
| Caro Cocha | 8 | 17 |
| " | 9 | 23 |
| " | 10 | 35 |
| " | 11 | 26 |
| " | 12 | 15 |
| " | 13 | 32 |
| " | 14 | 29 |
| " | 15 | "40 |
| " | 16 | 22 |
| " | 17 | 20 |
| " | 18 | 18 |
| " | 19 | 26 |
| " | 20 | 33 |
| " |
21 |
45 |
|
Santa Cruz |
22 |
25 |
| " | 23 | 33 |
| " | 24 | 36 |
| " | 25 | 17 |
| " | 26 | 32 |
| Santa Zulema | 27 | 30 |
| " | 28 | 47 |
| " | 29 | 52 |
| " | 30 | 39 |
| " | 31 | 27 |
| " | 32 | 35 |
| " | 33 | 44 |
| " |
34 |
33 |
| X ="
29 |
Los árboles de dormir estuvieron ubicados
a 100 m de la orilla de las lagunas. En estos ambientes tienden a despertarse
entre las 05:10 a 5:20 h, iniciando sus actividades diarias entre las 05:20
a 05:40 h en días de sol, y entre las 06:00 y 08:00 h en días
lluviosos. Durante la mayor parte de su recorrido son acompañados por
aves insectívoras como Crotophaga major, Monasa nigrifrons, Cacicus
sp. y ocasionalmente por Ramphocelus sp., dando la impresión
que existe una asociación mutua con estas especies. Las manadas de Saimiri
al movilizarse por los árboles espantan insectos, que son aprovechados
por las aves y también por ellos. En retribución, las vocalizaciones
de las aves sirven de alarma para ponerlos en alerta de sus depredadores.
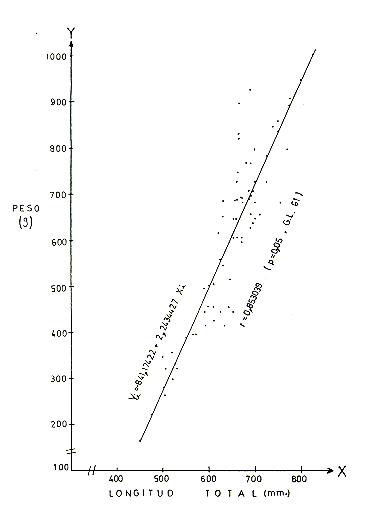
Fig.2.- Correlación peso y longitud total para los machos
de S. s. macrodon.
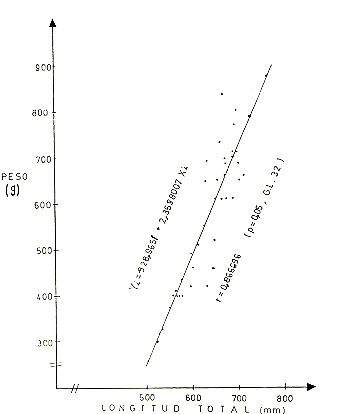
Fig.3.- Correlación peso y longitud total para las hembras de S.
s. macrodon.
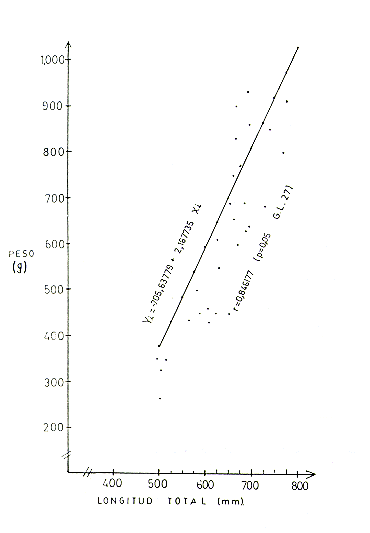
Fig.3.- Correlación peso y longitud total para ambos sexos de S.
s. macrodon.
Entre Abril y Mayo, época de abundancia de frutos en la Isla, los Saimiri permanecen más tiempo en las cercanías de los árboles alimenticios, adonde retornaron más de una vez al día a través de una misma ruta y por vanos días consecutivos. Durante la escasez de frutos que ocurre entre Octubre a Diciembre, las manadas de Saimiri tienden a dividirse en grupos menores, posiblemente debido a la competencia intraespecífica por los recursos. Durante esta época, el recorrido diario de las manadas también se amplía llegando en algunos casos hasta 1,5 km.
En cuanto a los árboles de dormir, éstos generalmente son frondosos y desprovistos de lianas, situados preferentemente próximos a masas de agua. Entre las especies de árboles utilizados para el sueño resaltan por su mayor frecuencia Callycophyllum sp. y Ficus spp. Soini y Moya (este volumen) también mencionan como árbol de dormir a Scheelea sp. y Bombax sp.
Tamaño de las manadas
En las 34 manadas de Saimiri observadas, el tamaño varió desde 13 a 52 animales, siendo el promedio de 29 individuos/ manada (Cuadro D. Estos datos son similares a los reportados para esta misma Isla por Soini y Moya (este volumen).
Estructura de edad de la población
El análisis de la estructura de edad está basado en una muestra de 207 ejemplares atrapados y censados, pertenecientes a 15 manadas. Los animales fueron clasificados en 4 categorías de edad, y son como sigue:
Infantes:
Individuos cuya edad estimada es menor a 1 año; con dentadura de leche; genitales no desarrollados, tamaño corporal pequeño; locomoción dependiendo en gran parte de la madre.
Juveniles:
Con edad estimada de uno a menos de 2 años; genitales externos poco desarrollados; dentadura permanente incompleta; mayor envergadura de los infantes; -independientes en su locomoción.
Subadultos:
Con edad estimada entre 2 y 3 años; genitales de ambos sexos con ligera pigmentación índice del estado de transición a la adultez.
Adultos:
Mayores de 3 años de edad; desarrollo físico completo; genitales externos completamente pigmentados y desarrollados; dentadura permanente y completa, algunas veces con dientes deteriorados especialmente los caninos.
En la muestra, 38,2% fueron adultos, 21,2% subadultos, 28,5% juveniles y 12,1 % infantes. El Cuadro 2 presenta la composición por niveles de edad de la muestra.
Composición por sexo
En la muestra poblacional, 51,2% fueron machos y 48,8% hembras. En la población de machos, 34,9% fueron adultos, 21,7% subadultos, 32,1% juveniles y 11,3% infantes. En las hembras, 41,6% fueron adultas, 20,8% subadultas, 24,7% juveniles y 12,1% infantes (Cuadros 3 y 4). La muestra analizada indica una estructura poblacional cuya forma representa una pirámide invertida, donde el máximo porcentaje correspondió a los adultos, tanto en la muestra total como por sexos (Cuadro 4). La proporción macho/hembra fue de 1,05:1,00. Estos resultados difieren de los datos de Soini y Moya (este volumen), quienes encontraron una proporción de 1,00:1,80. Sin embargo, debemos señalar que la muestra poblacional del presente estudio no incluía manadas completas.
Densidad poblacional
Las densidades poblacionales de Saimiri fueron estimadas para las cuatro áreas de estudio (Cuadro S). De ellas, Santa Cruz albergó la mayor densidad con 119 individuos/km2.
Reproducción
S. s. macrodon tiene un ciclo reproductivo anual definido. El apareamiento ocurre entre Julio y Agosto, y con menor intensidad en Setiembre. Durante este período se observaron cambios fisiológicos y de comportamiento en los machos, corroborando así las observaciones realizadas por Dumond y Hutchinson (1967) y Baldwin (1971). Son animales altamente sociales entre adultos de ambos sexos, pero irascibles con los infantes y juveniles en época de apareamiento. Se observaron hembras en avanzado estado de preñez a fines de Setiembre y Marzo. Las crías nacieron a partir de mediados de Diciembre y Marzo. El tiempo aproximado de gestación es de 5,5 meses (Beischer y Furry 1964, Hopf et al. 1967, Cooper 1968, Rosenblum 1968).
Comportamiento
Saimiri se caracteriza por su movilización bulliciosa ocasionada por sus vocalizaciones y saltos. A medida que avanzan van alimentándose de frutos e insectos. Frecuentemente bajan a 3 m de altura del suelo para cazar insectos y arañas; algunos inclusive descienden hasta el suelo en busca de insectos y frutos caídos entre la hojarasca.
Cuadro 2.- Composición por niveles
de edad de una muestra poblacional de 207 animales, tomada de 15 manadas de
S. s. macrodon, estudiadas en la Isla de Iquitos, Setiembre 1982 - Octubre
1983.
|
Manada Nº |
N° de individuos muestreados |
Categorización por niveles de edad |
TOTAL | ||||
|
Capturados |
Censados |
Adultos |
Subadultos |
juveniles |
Infantes | ||
|
1 |
7 |
12 |
7 |
4 |
5 |
3 |
19 |
|
3 |
14 |
4 |
11 |
3 |
4 |
- |
18 |
|
4 |
4 |
13 |
7 |
4 |
6 |
- |
17 |
|
5 |
10 |
3 |
4 |
2 |
6 |
1 |
13 |
|
7 |
- |
10 |
2 |
3 |
1 |
4 |
10 |
|
9 |
- |
12 |
1 |
4 |
6 |
1 |
12 |
|
10 |
3 |
13 |
4 |
5 |
7 |
- |
16 |
|
12 |
- |
8 |
3 |
1 |
4 |
- |
8 |
|
15 |
8 |
9 |
8 |
3 |
3 |
3 |
17 |
|
16 |
3 |
8 |
6 |
2 |
3 |
- |
11 |
|
22 |
- |
12 |
2 |
1 |
6 |
3 |
12 |
|
24 |
2 |
12 |
7 |
4 |
3 |
- |
14 |
|
27 |
- |
15 |
5 |
3 |
2 |
5 |
15 |
|
30 |
12 |
1 |
7 |
2 |
1 |
3 |
13 |
|
33 |
- |
12 |
5 |
3 |
2 |
2 |
12 |
|
TOTALES |
63 |
144 |
79 |
44 |
59 |
25 |
207 |
Cuadro 3.- Composición por sexo de una muestra poblacional de 207
animales, tomada de 15 manadas de S. s. macrodon de la Isla de Iquitos
| Manada N° | N° de individuos muestrados | achos | Hembras | TOTAL | |||
| Capturados |
Censados |
Número |
Porcentaje |
Número |
Porcentaje | ||
| 1 | 7 | 12 | 9 | 47,4 | 10 | 52,6 | 19 |
| 3 | 14 | 4 | 5 | 27,8 | 13 | 72,2 | 18 |
| 4 | 4 | 13 | 12 | 70,6 | 5 | 29,4 | 17 |
| 5 | 10 | 3 | 6 | 46,2 | 7 | 53,8 | 13 |
| 7 | - | 10 | 5 | 50,0 | 5 | 50,0 | 10 |
| 9 | - | 12 | 5 | 41,7 | 7 | 58,3 | 12 |
| 10 | 3 | 13 | 7 | 43,8 | 9 | 56,2 | 16 |
| 12 | - | 8 | 4 | 50,0 | 4 | 50,0 | 8 |
| 15 | 8 | 9 | 14 | 82,4 | 3 | 17,6 | 17 |
| 16 | 3 | 8 | 3 | 27,3 | 8 | 72,7 | 11 |
| 22 | - | 12 | 7 | 58,3 | 5 | 41,7 | 12 |
| 24 | 2 | 12 | 8 | 57,1 | 6 | 42,9 | 14 |
| 27 | - | 15 | 7 | 46,2 | 8 | 53,3 | 15 |
| 30 | 12 | 1 | 5 | 38,5 | 8 | 61,5 | 13 |
| 33 | - | 12 | 9 | 75,0 | 3 | 25,0 | 12 |
| TOTALES | 63 | 144 | 106 | 51,2 | 101 | 48,8 | 207 |
Cuadro 4.- Composición de la muestra poblacional por edad y sexo de macrodon de la Isla de Iquitos
|
Machos |
Hembras |
Proporción | ||
|
n |
% |
n |
% |
macho/hembra |
|
|
37 | 34,9 | 42 | 41,6 | 0,88 : 1,0 |
|
23 | 21,7 | 21 | 20,8 | 1,09 1,0 |
|
34 | 32,1 | 25 | 24,7 | 1,36 1,0 |
|
12 | 11,3 | 13 | 12,9 | 0,92 : 1,0 |
|
106 | 100,0 | 101 | 100,0 | 1,05 : 1,0 |
Cuadro 5.- Número de manadas ubicadas y ejemplares censados en las
4 áreas estudiadas en la Isla Iquitos en Agosto 1982-Octubre 1983
|
Manadas |
Total animales |
Area de Censo km2 |
Densidad |
|
|
Man./km2 |
ind./km2 | ||||
|
7 | 143 | 3,1 | 2,3 | 46 |
|
14 | 381 | 3,8 | 3,7 | 100 |
|
5 | 143 | 1,2 | 4,2 | 119 |
|
8 | 307 | 3,3 | 2,4 | 93 |
|
34 | 974 | 11,4 | 3,0 | 85,4 |
Saimiri frente a los plátanos colocados como cebo dentro y fuera de la jaula mostró recelo y timidez. Generalmente, cuando una manada llega a la jaula con cebo, primero acostumbra a observar los alrededores como medida de precaución, pero es suficiente el ingreso de un ejemplar para que el resto también lo haga para alimentarse. Otros tratan de comer desde fuera de la jaula, introduciendo sus manos por la malla, y logran arrancar pedazos de plátanos. La disputa por el cebo se manifiesta por las ruidosas vocalizaciones y en ocasiones incluso llegan a la agresión física.
Alimentación
Saimiri tiende a alimentarse durante todo el día. La proporción del consumo de frutos e insectos varía de acuerdo a la disponibilidad de estos recursos. Baldwin y Baldwin (1972) y Fleagle y Mittermeier (1980) también mencionan que estos primates se alimentan durante todas las horas del día, ingiriendo una cantidad considerable de frutos, pero también gran parte de su actividad diaria la dedican a la búsqueda de insectos. El Cuadro 6 contiene una lista de los frutos que Saimiri consumió en la isla.
En la isla, excepto de Octubre a Diciembre, hay diversidad de frutos, sobresaliendo por su abundancia, Inga spp. y Cecropia spp. Soini y Moya (este volumen) clasificaron los árboles alimentarios según su patrón temporal de fructificación en árboles de fructificación sincrónica, asincrónica y continua. Durante la escasez temporal de frutos, Saimiri también se alimenta de mazorcas inmaduras de maíz (Encarnación, este volumen), al cual fácilmente se adaptan como cualquier otro animal silvestre.
Relaciones interespecíficas
Un aporte importante constituye la verificación de la existencia de un grupo de Cebus albifrons en esta isla, que fue observado el 27 de Abril conjuntamente con Saimiri en el Sector de Caro Cocha. El grupo de Cebus conformado por cinco ejemplares guiaba a la manada de Saimiri.
En la mayoría de los casos, las manadas de Saimiri fueron encontradas en asociación con Crotopliaga major, ave insectívora muy abundante en la isla, y en menor proporción con Cacicus cela y Monasa sp., concordando así con las observaciones de Soini y Moya (este volumen). Esta asociación se debe a la atracción mutua por los insectos, que abundan en las riberas de las masas de agua y en la vegetación secundaria (Soini y Moya, este volumen). Otras aves como Ramphastos sp. y Tigrisoma lineatum, fueron observadas volando intempestivamente, causando alarma y desconcierto a estos primates cuando se encontraban descansando. Baldwin y Baldwin (1972) también observaron interacciones entre Saimiri y otras especies de animales sin llegar a un contacto físico, sino más bien demostrando cierto temor hacia las aproximaciones cercanas de estas especies, incluido el hombre. Sin embargo, Saimiri pierde temor a este último cuando es observado por varios días consecutivos.
Cuadro 6.- Especies de frutos consumidos
por Saimiri sciureus macrodon en la Isla de Iquitos. Agosto 1982-Octubre
1983
| Nombre Científico | Nombre Vulgar | Familia |
| Artocarpus altílis | pan de árbol | Moraceae |
| Cecropia sp. | cetico | Moraceae |
| Chrysophyllum caimito | caimitillo | Sapotaceae |
| Ficus spp. | renaco | Moraceae |
| Genipa americana | hulto | Rubiaceae |
| Inga spp. | shimbillo | Leguminosae |
| Inga spp. | guavilla | Leguminosae |
| Mouríri sp. | lanza huayo | Melastomataceae |
| Muntingia calabura | yumanasa | Elaeocarpaceae |
| Ogeodeía tamamuri | tamamuri | Moraceae |
| Passiflora ligularis | granadifia | Passifloraceae |
| Physalis angulata | bolsa mullaca | Solanaceae |
| Pauteria raimíto | caimito | Sapotaceae |
| Prunus sp. | bushom | Rosaceae |
| Rheedia sp. | charichuelo | Guttiferae |
| Theobroma sp. | cacahuillo | Sterculiaceate |
CONCLUSIONES
La especie objeto de este estudio corresponde a Saimiri sciureus macrodon Elliot 1907, cuyo hábitat preferido en la Isla de Iquitos es el bosque ubicado cerca a los canales, lagunas y terrenos de cultivo en abandono.
El tamaño promedio fue de 29 animales/manada, con un rango de 13 a 52 individuos. En la muestra estudiada, los adultos fueron más representativos que los infantes.
La proporción macho/hembra fue 1,05:1,00. Sin embargo, a nivel de sexos los adultos tanto en machos como en hembras fueron los más representativos.
Existe una correlación significativa entre el peso y la longitud total en machos, hembras y ambos sexos.
La densidad poblacional de Saimiri en la Isla de Iquitos fue estimada en 3,0 manadas/km2 y 85,4 individuos/km2.
En la Isla de Iquitos es común la asociación de Saimiri con Crotophaga major, principalmente en época de escasez de frutos.
RESUMEN
En la Isla de Iquitos se efectuó un estudio sobre la bioecología de la especie identificada como Saimiri sciureus macrodon. El hábitat preferido de esta especie es el bosque ubicado cerca a las masas de agua y terrenos de cultivo en abandono.
Datos sobre el tamaño de las manadas, composición por edad, proporción de sexos, densidad poblacional y otras observaciones biológicas son analizadas y presentadas en este documento.
REFERENCIAS
Baldwin, J.D. 1971. The social organization of a semifree-ranging troop of squirrel monkeys (Saimiri sciureus). Folia Primatol. 14:23-50.
Baldwin, J.D. y J. 1. Baldwin. 1971. Squirrel monkeys (Saimiri) in natural habitats in Panama, Colombia, Brazil and Perú. Primates 12(l): 45-61.
Baldwin, J.D. y J. 1. Baldwin. 1972. The ecology and behavior of squirrel monkeys (Saimiri oerstedi) in a natural forest in Western Panama. Folia Primatol. 18:161-184.
Beischer, D. y D. Furry. 1964. Saimiri sciureus as an experimental animal. Anat. Rword 148:615-624.
Brack, A. 1975. Mapa de las Regiones Eco-Zoogeográficas del Perd. Lima-Perú
Cooper, R. 1968. Squirrel monkey, taxonomy and supply. pp. 1-29. En L.A. Rosenblum y R.W. Cooper, (Eds.). The Squirrel Monkey. Academic Press, New York.
Dumond, F.V. y T.C. Hutchinson. 1967. Squirrel monkey reproduction: The "fatted" male phenomenon and seasonal spermatogenesis. Science 158:1067-1070.
Dunn, F. L. 1968. The parasites of Saimiri: In the context of Platyrrhine parasitism. pp. 31-68. En L. H. Rosenblum y R. W. Cooper (Eds.). The Squirrel Monkey. Academic Press, New York.
Encarnación, F. (este volumen). Aspectos de la. adaptación de Saindri sciureus Linnaeus, "Fraile" (Primates-Cebidae) a nuevas fuentes alimenticias en la Amazonia Peruana.
Fleagle, J.G. y R.A. Mittermeier. 1980. Locomotor behavior, body size, and comparative ecology of seven Surinam monkeys. Am. 1. Phys. Anthrop. 52:301-314.
Fleagle, J. G., R.A. Mittermeier y A. Skopec. 1981. Differential habitat use by Cebus apella and Saimiri sciureus in Central Surinam. Primates 23 (3):361-367.
Freese, C. 1975. Informe Final sobre el censo de simios en el Perú. AMRO-3170. 25 pp.
Hershkovitz, P. 1984. Taxonomy of squirrel monkey genus Saimiri (Cebidae, Platyrrhini): A preliminary report with description of a hitherto unnamed form. Amer. 1. Primatol. 6: 257-312.
Hopf, S., J. Latta y D. Ploog. 1967. Observation on mating behavior and sexual play in the squirrel monkey (Saimiri sciureus). Primates 8(3):229-245.
Malleux, J. 1975. Mapa Forestal del Perú. (Memoria Explicativa). Univ. Nac. Agraria U Molina, Lima. 161 pp.
Moya, L., C. Ique y P. Soini. (este volumen). Introducción experimental y manejo de 11 pichico barba blanca" (Saguinus mystax Spix 1823), Primates-Callitrichidae en Padre Isla. Loreto-Perd.
Oficina Nacional de Evaluación de Recursos Naturales, (ONERN). 1976. Mapa Ecológico del Perú y Guía Explicativa. Lima. 146 pp.
Rosenblum, L.A. 1968. Some aspects of female reproductive physiology. pp. 147-611. En L. A. Rosenblum y R. W. Cooper (Eds.). The Squirrel Monkey. Academic Press, New York.
Smith, M., J. P. Newman, D. E. Bernhards y D. Symmes. 1983. Effect of reproductive state on vocalization in squirrel monkeys (Saimiri sciureus). Folia Pri"wtol. 90: 236-246
Soini, P. (este volumen). Informe de los resultados de una investigación preliminar de la fauna de la Isla Iquitos e islas adyacentes.
Soini, P. y L. Moya. (este volumen). Informe de los resultados de los estudios primatológicos en la Zona Norte de la Isla Iquitos.
Sokal, R . y J.F. Rohlf. 1979. Biometría: Principios y métodos estadísticos en la investigación biológica. H. Blume, Ed., Madrid-España. 832 pp.
Thorington, R.W. 1968. Observation of squirrel monkeys in
a Colombian Forest. pp. 69-84. En L.A. Rosenblum y R. W. Cooper (Eds.). Academic
Press, New York.

ESTUDIOS BIOECOLOGICOS DE TRES GRUPOS DEL PICHICO BARBA BLANCA (Saguinus mystax SPIX 1823) EN PADRE ISLA (IQUITOS)*
(*Compendio de la Tesis para optar el Titulo de Biólogo.
Universidad Nacional Agraria La Molina. Lima, Perú, 1985).
Cecilia Gazzo
INTRODUCCIÓN
Saguinus mystax, llamado comúnmente "pichico barba blanca ' es un primate de la familia Callitrichidae, habitante del bosque húmedo tropical de la Amazonía Peruana. Se distribuye al Oeste y Sur de los Ríos Huallaga-Marañón (Hershkovitz 1977). Es una especie utilizada en investigaciones biomédicas, por ser un buen sujeto de experimentación para ciertas enfermedades humanas, especialmente la hepatitis viral tipo A.
Desde que el Gobierno Peruano decretó la veda por tiempo indefinido (D.S. 934-73-AG) y casi total para la fauna de la Amazonía, se ha venido desarrollando una serie de programas, tanto de crianza en cautiverio (Guayabamba, Iquitos) como de estudios y manejo de poblaciones naturales y en semicautiverio o islas (Padre Isla e Isla Iquitos), con la finalidad de realizar un manejo racional del recurso primates, y en esa forma poder continuar con las investigaciones biomédicas. Los objetivos del presente estudio fueron: conocer el comportamiento y la adaptación ecológica de Saguinus mystax introducidos en Padre Isla, analizando principalmente la alimentación, demografía y locomoción.
MÉTODOS
El área de estudio es una isla del Río Amazonas denominada Padre Isla, situada a 03'44'S y 73'14'0, al NE de Iquitos (Loreto). Según el Mapa Ecológico del Perú (ONERN 1976), forma parte del Bosque Húmedo Tropical y, de acuerdo a la clasificación forestal (Malleux 1975), está considerada como Bosque Aluvial Tipo III.
Durante el período de observaciones, la temperatura media fue de 26'C, la humedad relativa de 78% en promedio anual y la precipitación anual estimada de 3132 mm (SENAMHI 1982-1983). Los suelos son de origen aluvial, con fisiografía de restingas: pequeñas depresiones con colinas adyacentes atravesadas por cuerpos de agua lénticos o lagos meándricos (cochas) (Encarnación et al., este volumen).
Las formaciones fisiográficas dominantes son la de bajial o tahuampa y la de restinga. La primera permanece inundada durante buena parte del año y posee alto porcentaje de arcilla (35%) y limo (48%); se puede diferenciar un bosque de galería donde predominan especies vegetales de ribera como charichuelo, cetico, shimbillo, huiririma, bijau y otras. Las restingas tienen suelos aluviales con mayor porcentaje de arena (50% o más), y por ser más elevadas se inundan sólo en períodos de creciente máxima; las especies vegetales representativas son las guavas, guavillas, caimito, pashaco, ojé, entre otras.
Entre Setiembre 1982 y Agosto 1983, se estudiaron tres manadas de Saguinus mystax: la manada celeste y la manada roja, habitantes de la restinga Barbón, y la manada ceIeste-blanca de la restinga Central (Fig. 1).
Se diseño y ejecutó un plan de actividades que comprendió cinco fases:
Ubicación de las áreas de estudio y selección
de las manadas a estudiar.
Medición y marcación de los principales caminos
o transectos del área de estudio. Cada 100 m se colocó una
placa de metal (5 x 3 cm) de color rojo, con el número del transecto
y la distancia en metros desde el origen.
Apertura y señalización de transectos auxiliares
en las zonas donde se observó las manadas de estudio. Cada 25 m se
colocó una cinta plástica de color rojo, y al inicio y final
del transecto una placa numerada, de color verde.
Se levantó un mapa básico a escala 1/27 000,
donde se graficó los transectos y se anotó las señalizaciones,
ubicación de los árboles de comer, árboles de dormir,
territorios de las manadas, entre otros.
Observaciones directas de las manadas seleccionadas. Se combinó
el método "ad-libitum", que consistía en recoger
la mayor cantidad de información posible de las actividades realizadas
por S. mystax durante el período de observación, con el método
"Animal Focal", en el cual se observaba por un determinado período
de tiempo (5 minutos en el presente estudio) a cada animal del grupo, registrando
sus actividades en ese lapso. Luego de haber observado a todos los miembros
del grupo, se iniciaba nuevamente el circuito, volviendo a observar a cada
uno por 5 minutos. La elección del animal a observar era siempre
al azar. Con este sistema, se obtuvo datos de frecuencia y duración
de las actividades.
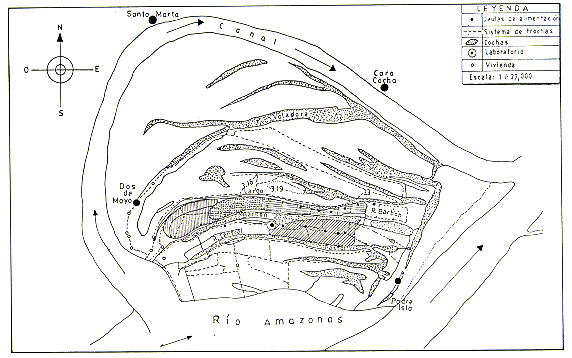
Fig.1. - Mapa de Padre Isla con la ubicación de los territorios
de las tres manadas
de S. mystax estudiadas. Celeste ![]() ,
roja
,
roja ![]() y celeste
blanca
y celeste
blanca ![]()
La identificación en el terreno de algunas
especies vegetales consumidas por los S. mystax fue realizada por el
botánico del Proyecto Primates (F. Encarnación). En otras oportunidades,
se colectó muestras para su posterior identificación. Se confeccionó
una clave para identificar las especies consumidas; cada especie fue identificada
con una letra y un número que figuraba en una placa de color amarillo
adherida en su corteza.
RESULTADOS Y DISCUSIÓN
Alimentación
Se pudo constatar que S. mystax es una especie principalmente frugívora e insectívora. También consume exudados y, en menor proporción, brotes, flores, hojas tiernas, larvas, arañas y pequeños vertebrados. En el Cuadro 1, puede observarse que el 65% de la alimentación fue de origen vegetal y el 35% de origen animal. Entre los alimentos de origen vegetal fueron más importantes los frutos (43,7%) y el exudado (19,6%); entre los de origen animal, los insectos adultos (32,6%), ortópteros y lepidópteros, principalmente. También se registró ocasionalmente el consumo de pequeños reptiles y batracios. Esto fue reportado por Neyman (1977) y por Soini (este volumen) para otras especies del mismo género. La principal fuente de exudado fue el pashaco (Stryphnodendron sp., Leguminosae), pero también utilizaron exudado de algunas especies del género Inga. No mordían la corteza sino solamente lamían lo que brotaba por lenticelas o por agujeros producidos por insectos.
Como se puede apreciar, al disminuir la disponibilidad de frutos (Noviembre-Enero) aumentó el consumo de insectos y exudado. Esto coincide con lo observado por Soini (este volumen) para S. fuscicollis. En este gráfico se observa también el orden decreciente de la importancia de los alimentos: frutos, insectos y exudado. Los otros tipos de alimentos utilizados (brotes, hojas, arañas, vertebrados y otros) fueron consumidos en una mayor proporción durante la época de escasez de frutos.
Las especies vegetales más consumidas pertenecen a las familias Leguminosae (56%) y Moraceae (20,6%), como puede verse en el Cuadro 2, destacando entre ellas la guavilla (Inga sp.) de la primera familia y el renaquillo (Ficus sp.) de la segunda. También fueron importantes en la dieta de S. mystax el charichuelo (Guttiferae), huito (Rubiaceae) y caimito (Sapotaceae).
En los meses de escasez de frutos (Noviembre-Enero, época crítica), los monos utilizaron nuevas especies vegetales, aunque consumieron sólo pocos frutos de cada una de ellas, evidenciándose cierto proceso de adaptación a nuevas fuentes alimenticias. La diversidad de especies utilizadas fue mayor. En cambio, en la época de abundancia (Agosto-Octubre), consumieron pocas especies pero gran cantidad de frutos, pues hay mucha disponibilidad de guavas y guavillas (Inga spp.) (Fig. 2).
Cuadro 1.- Tipos de alimentos consumidos por Saguinus mystax en Padre Isla.
Observaciones de Setiembre 1982 a Agosto 1983
(no hubo observaciones durante Febrero, Abril, Mayo y Julio de 1983)
|
Tipos de Alimentos |
Número de observaciones por mes |
Totales | ||||||||||||
|
Set |
Oct |
Nov |
Dic |
Ene |
Feb |
Mar |
Abr |
May |
jun |
jul. |
Ago |
Observ |
% |
|
| Vegetales | ||||||||||||||
| - frutos |
23 |
69 |
69 |
42 |
53 |
36 |
- | - | - |
9 |
- |
79 |
380 |
43,7 |
| - exudados |
- |
16 |
44 |
54 |
15 |
- | - | - | - | - | - |
42 |
171 |
19,6 |
| - brotes |
- |
3 |
2 |
2 |
- |
- |
- |
- |
- |
- |
- |
1 |
8 |
0,9 |
| - flores | - | - | - | - |
2 |
- |
3 |
- | - | - | - | - |
5 |
0,6 |
| - hojas | - | - | - | - |
1 |
- |
1 |
- | - | - | - | - | 2 | 0,2 |
| Sub total de observaciones |
23 |
88 |
115 |
98 |
71 |
- |
40 |
- |
- |
9 |
- |
122 |
566 |
|
|
% |
2,6 |
10,1 |
13,2 |
11,3 |
8,2 |
- |
4,6 |
- |
- |
1,0 |
- |
14,0 |
65,0 |
|
| Animales | ||||||||||||||
| Animales |
11 |
30 |
65 |
59 |
54 |
- |
8 |
- |
3 |
- |
53 |
283 |
32,6 |
|
| -Insectos
adultos |
- |
4 |
4 |
2 |
3 |
1 |
- |
1 |
- |
4 |
19 |
2,2 |
||
| -larvas, orugas y arañas |
1 |
- |
- |
- |
- |
- |
1 |
2 |
0,2 |
|||||
|
- vertebrados |
- | |||||||||||||
| - subtotal de
observaciones |
11 |
34 |
69 |
62 |
57 |
-9 |
- |
4 |
- |
58 |
304 |
|||
|
% |
1,3 |
3,9 |
7,9 |
7,1 |
6,6 |
- 1,0 |
- |
0,5 |
- |
6,6 |
34,9 |
|||
| TOTALES | ||||||||||||||
| observaciones |
34 |
122 |
184 |
160 |
128 |
49 |
- | - |
13 |
- |
180 |
870 |
||
| % |
3,9 |
14,0 |
21,1 |
18,4 |
14,7 |
5,6 |
- | - |
1,5 |
|
20,7 |
99,9 |
||
Cuadro 2.- Variación estacional de la utilización
de especies vegetales por S. mystax en Padre Isla.
Observaciones de Setiembre 1982 a Agosto 1983
(no hubo observaciones durante Febrero, Abril, Mayo y Julio dé 1983).
|
Tipos de Alimentos |
Número de observaciones por mes |
Por especies | Por familias | |||||||||||||
|
Set |
Oct |
Nov |
Dic |
Ene |
Feb |
Mar |
Abr |
May |
jun |
jul. |
Ago |
Observ |
% |
Observ |
% |
|
| Annonaceae | ||||||||||||||||
| "anonilla" | - | - | 2 | - | - | - | - | - | - | - | - | - | 2 | 0,4 | 2 | 0,4 |
| Chrysobalanaceae | ||||||||||||||||
| "parinari" | - | 4 | - | - | - | - | - | - | - | - | - | - | 4 | 0,7 | 4 | 0,7 |
| Elaeocarpaceae | ||||||||||||||||
| "Yumanasa" Guttiferae "charichuelo" |
1 |
- |
2 |
- |
2 |
- |
1 |
- |
- | - | - |
14 |
20 |
3,6 |
20 |
3,6 |
|
Leguminosae |
||||||||||||||||
| "guava" |
10 |
3 |
3 |
4 |
- |
- |
4 |
- |
- | - | - |
7 |
31 |
5,6 |
- | - |
| "guavilla" | 9 | 37 | 1 | 1 | - | - | - | - | - | 2 | - | 11 | 61 | 11,1 | - | - |
| "shimbillo" | 1 | 1 | 14 | 4 | 4 | - | 2 | - | - | 1 | - | 17 | 44 | 8,0 | 136- | 24,8 |
| "pashaco" | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| (exudados) | - | 16 | 44 | 54 | 15 | - | - | - | - | - | - | - |
171 |
31.2 |
171 |
31.2 |
|
307 |
56,0 |
|||||||||||||||
| Meliaceae | ||||||||||||||||
| "requia" (flores) | - | - | 2 | 1 | 1 | - | 1 | - | - | - | - | - | 5 | 0,9 | 5 | 0,9 |
| Moraceae | ||||||||||||||||
| "cetico" | - | - | - | - | - | - | - | - | - | 1 | - | 9 | 10 | 2,0 | - | - |
| "ojé" | - | 3 | 7 | 10 | 8 | - | 3 | - | - | - | - | 4 | 35 | 6,6 | - | - |
| "
renaco" |
- | - | - | - | 9 | - | 7 | - | - | - | 16 | 3,0 | - | - | ||
|
"renaquillo" |
- |
4 |
20 |
14 |
9 |
- |
- |
- | - | 5 | 52 | 9,5 | 113 | 20,06 | ||
| Myristicaceae | ||||||||||||||||
| "cumala" | - | - | - | 2 | - | - | - | - | - | - | - | - | 2 | 0,4 | 2 | 0,4 |
| Myrtaceae | ||||||||||||||||
| "palillo" | - | - | 3 | - | - | - | - | - | - | - | - | - | 3 | 0,5 | - | - |
| "poma-rosa" | 2 | - | - | - | - | - | - | - | - | - | - | - | 2 | 0,4 | 5 | 0,9 |
| Palmae | ||||||||||||||||
| huiririma | - | - | - | - | - | - | 5 | - | - | - | - | - | 5 | 0,9 | - | - |
| "ñejilla" | - | - | - | - | 2 | - | 5 | - | - | - | - | - | 7 | 1,3 | 12 | 2,3 |
| Passifloraceae | ||||||||||||||||
| "granadilla" | - | - | - | - | 10 | - | 4 | 4 | 4 | 22 | 4,0 | 22 | 4,0 | |||
| "pepinillo" | ||||||||||||||||
| Rubiaceae | ||||||||||||||||
| "huito" | 2 | 9 | 5 | 6 | 1 | - | - | - | - | 1 | - | 6 | 30 | 5,4 | 30 | 5,4 |
| Sapotaceae | ||||||||||||||||
| "caimito" | - | 10 | 12 | - | 3 | - | - | - | - | - | - | 1 | 26 | 4,7 | 26 | 4,7 |
| TOTALES | ||||||||||||||||
| Observaciones | 25 | 83 | 113 | 96 | 68 | - | 34 | - | - | 9 | - | 120 | 548 | - | 548 | - |
| % | 4,6 | 15,1 | 20,6 | 17,5 | 12,4 | - | 6,2 | - | - | 1,6 | - | 21,9 | - | 99,9 | - | 99,9 |
* referencias
La mayor actividad alimenticia fue registrada por la mañana, entre las 7:30 y 10:30 h, y en la tarde había un ligero incremento entre las 14:30 y 15:39 h. En el Cuadro 3 pueden verse algunas características de las especies consumidas.
Estructura del grupo
Los individuos de S. mystax observados viven en manadas o grupos familiares, cuyo tamaño promedio fue de 6 individuos de locomoción independiente. Esta información es casi similar a la encontrada por otros autores: 5,3 por Soini y Soini (este volumen), 4,5 por Moya et al. (este volumen), 6 por Aquino (este volumen) y 5 por Ramírez (1984).
Del total de animales estudiados, el 54,5% fueron machos y el 45,4% hembras. Hubo sólo una hembra adulta por grupo; otras hembras eran crías, Juveniles o subadultas; pero sí habían dos o tres machos adultos. No se pudo constatar si en cada manada sólo uno de los machos era reproductor y pareja de la hembra adulta; pero si se asume la hipótesis de que el padre de las crías era quien las cargaba y cuidaba, entonces podríamos afirmar que un solo macho es la pareja reproductora o macho alpha, pues generalmente se vio al mismo individuo cuidando a las crías.
Durante el período de observaciones, la pareja reproductora
de cada manada permaneció estable, pero entre los otros miembros de los
grupos se registró algunas migraciones: dos miembros de la manada celeste
(un adulto y un subadulto) emigraron a otros grupos. A la manada celeste-blanca,
llegaron dos subadultos provenientes de una manada vecina. El grupo rojo desapareció
durante su captura, 6 individuos murieron con "tembladera" (enfermedad
cuya causa y tratamiento se desconocen aún), quedando sólo una
hembra joven, que no fue capturada y que formó un nuevo grupo con tres
machos que emigraron de otras manadas. Se registró el nacimiento de dos
pares de mellizos, uno en la manada celeste y otro en la manada celeste-blanca.
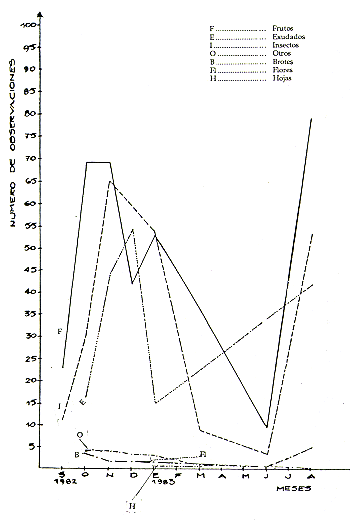
Fig. 2. - Tipos de alimentos consumidos por S. mystax durante el
período de observaciones (Set. 1982 - Ago. 1983)
Cuadro 3.- Características de las especies vegetales utilizadas por Saguinus mystax en Padre Isla, Iquitos
Fuente principal de información: Encarnación
et al. (este volumen).
| Familia y nombre común | Nombre científico | Forma vegetal | Hábitat | Tipo de fruto |
|
Annonaceae |
||||
| "anonilla" | Annona sp. | arbusto | terrestre | baya |
|
Chrysobalanaceae |
||||
| "parinari" | Couepia subcordata | drupáceo | ||
|
Elaeocarpacese |
||||
| "yumanasa" | Muntingia calabura | árbo4 arbusto | terrestre | baya |
|
Cuttiferae |
||||
| "charichuelo" | Rheedia sp. | árbol | terrestre | baya |
|
Leguminosae |
||||
| "guava" | Inga sp. | árbol | terrestre | legumbre |
| "guavilla" | Inga sp. | árbol | terrestre | legumbre |
| shimbillo | Inga sp. | árbol, arb | terrestre | legumbre |
| "pashaco" | Stryphnodendron sp. | árbol | terrestre | legumbre |
|
Meliaceae |
||||
| "requia" | Cuarea sp. | árbol | terrestre | cápsula |
|
Moraceae |
||||
| "cetico" | Cecropia latiloba | árbol | terrestre, ripario | agregado |
| "Ojé" | Ficus insípida | árbol | terrestre, ripario | sicono |
| "renaco" | Ficus sp. | árbol | terrestre, ripario | sicono |
|
renaquillo" |
Ficus sp. | epífita | epífito | sicono |
|
Myristicaceae |
||||
| "curnala" | Iryanthera sp. | árbol | terrestre | cápsula |
|
Myrtaceae |
||||
| "palillo" | Campomanesia lineatifolia | árbol | terrestre | baya |
| "porna rosa" | Syzygium malacense | árbol | terrestre | baya |
|
Palmae |
||||
| "huiririma" | Astrocaryum sp. | estípite | ripario, terrestre | drupa |
| "ñejilla" | Bactris sp. | estípite | terrestre | drupa |
|
Passifloraceae |
||||
| "pepinillo" | árbol | terrestre | baya | |
| "granadilla" | Passiflora sp. | bejuco, liana | terrestre | baya |
|
Rubiaceae |
||||
| "huito" | Genípa americana | árbol | terrestre | baya |
|
Sapotaceae |
||||
|
"caimito" |
Pouteria caimito |
árbol |
terrestre |
baya |
Territorialidad
Cada una de las manadas estudiadas tenía un territorio bien definido y delimitado, que era defendido de las invasiones de las manadas vecinas. De acuerdo a la disponibilidad estacional de recursos alimenticios, iban explotando diversas zonas de su territorio. Se concentraban donde fructificaban las especies vegetales y recorrían periódicamente la totalidad de su territorio en busca de insectos, larvas, arañas, etc.
Se pudo observar a las hembras adultas en especial, marcando el territorio de la manada mediante el frotamiento, que consistía en que el animal se restregaba contra ramas de los árboles de comer, de dormir o simplemente de paso, aparentemente impregnándolos con feromonas producidas por ciertas glándulas localizadas en algunas zonas de su cuerpo.
El territorio de la manada celeste (Fig. 1) inicialmente era de 18 ha aproximadamente, situado en la restinga Barbón; luego se incrementó hasta 26 ha, con la invasión de una parte del territorio del grupo rojo, que era vecino. Durante la primera etapa del estudio explotaron intensivamente la zona Este de su territorio, donde se encontraban en fructificación guavas y guavillas; pero al agotarse este recurso fueron desplazándose paulatinamente hacia el territorio del grupo celeste, donde abundaba el pashaco, cuyo exudado aprovechaban. Durante la escasez de frutos, aprovechando que la manada roja había desaparecido en la captura, invadieron una zona donde fructificaban árboles de caimito y renaquillo. Posteriormente, cuando la manada roja se reconstituyó , hubo enfrentamiento territorial entre las dos manadas.
La manada roja original tenía un territorio de aproximadamente 22 ha, al Oeste del territorio de la manada celeste. La otra manada estudiada, la celeste-blanca, habitaba en la restinga Central, ocupando un territorio de 13 ha. Se pudo apreciar que existía superposición territorial con la manada celeste-roja, que era vecina.
No se tienen datos previos sobre la extensión del territorio de S. mystax, pero sí para otras especies del mismo género: Izawa (1978) observó territorios de 30 a 50 ha en S. nigricollis; Yoneda (1981) reportó para S. fuscicollis territorios de 32,8 ha en promedio y para S. labiatus 33,5 ha; y Terborgh y Goldizen (1981) reportaron territorios que variaban de 20 a 50 ha para S. fuscicollis y S. imperator. El hecho que las áreas domiciliarias observadas en este estudio hayan sido relativamente pequeñas, podría deberse a que las manadas habitaban bosques parcialmente secundarios y que, al haber zonas cultivadas por el hombre, hay mayor concentración de recursos alimenticios.
También el hecho que las manadas de la
isla no viven en asociación con otra especie de Saguinus, como es el
caso de los grupos estudiados por Terborgh y Goldizen (1981) y Yoneda (1981),
puede afectar el tamaño del área ocupada.
Uso del espacio vertical
S. mystax utilizó en mayor proporción (53%) el estrato medio del bosque para realizar sus actividades. También empleó el estrato alto (37%) y, en menor proporción, el estrato bajo ^). En otras áreas naturales se les ha observado utilizar el estrato alto con mayor frecuencia (Ramírez, com. pers.), pero las manadas estudiadas mostraron clara preferencia por el estrato medio, por tres posibles razones: la vegetación del estrato alto en los territorios habitados era muy discontinuo, presentándose sitios donde los monos necesariamente tenían que bajar a los estratos medio y bajo. Otro motivo, es que en el estrato medio encontraban la protección necesaria contra posibles predatores, por poseer éste un follaje más denso y con mayor abundancia de frutos e insectos.
Locomoción y posturas
" locomoción fue eminentemente cuadrúpeda, incluyendo subidas y bajadas por soportes verticales y saltos a troncos y ramas. Según Napier y Napier (1967), S. mystax es una especie cuadrúpeda y saltadora. Esto fue confirmado por Castro y Soini (1977) al afirmar que la locomoción en esta especie es básicamente cuadrúpeda, combinada con saltos horizontales y diagonales. Jolly (1972) indica que la locomoción cuadrúpeda de Saguinus incluye el correr y caminar por las ramas, trepar y saltar. A menudo el desplazamiento era ascendente y descendente, con saltos de 2 m o más y a diferentes alturas.
Pueden adoptar diversas posturas, variando de acuerdo con la actividad realizada. Para alimentarse se prendían con las extremidades posteriores a las ramas y con las anteriores manipulaban los frutos; podían estar colgados boca abajo o parados en dos o cuatro patas. Para consumir exudado subían y bajaban de cabeza por el tronco y ramas principales, buscando las zonas donde se había acumulado el exudado. Para el descanso y despioje social adoptaban posturas de sentados y echados sobre las ramas; descansaban con las extremidades anteriores y posteriores colgando, apoyándose en el pecho y abdomen, o con las piernas dobladas.
Patrón de actividades
El día de actividades de S. mystax duraba generalmente de 12 horas, aunque en varias oportunidades fue más corto, sobre todo en la época crítica.
Usualmente salían de su árbol de dormir entre las 5:40 - 6:00 h. La primera actividad consistía en dirigirse al árbol de alimentación más próximo. Como dormían cerca de sus fuentes alimenticias, este desplazamiento era corto.
Durante la mañana, la actividad del grupo era mayor, sobre todo entre las 6:30 - 10:30 h, en que se dedicaban al consumo de frutos, exudados, etc. Se desplazaban en busca de insectos y vocalizaban con mayor frecuencia. Estas actividades eran combinadas con el descanso a mediodía. Entre las 11:30 y 13:30 h, con alta temperatura, se les podía observar descansando y dedicados al despioje social en la parte más tupida del estrato medio. (Fig. 3).
Por la tarde, entre las 14:30 y 15:30 h, se producía un ligero incremento en la actividad, sobre todo en la alimentación y el desplazamiento. Generalmente regresaban a su árbol de dormir entre las 17:30 y 18:00 h.
Dedicaron más del 34% de su tiempo al consumo de frutos y exudado, 13% a la búsqueda y Captura de insectos, 32% al desplazamiento, y 19% al descanso, despioje y juego. Se observó una marcada fluctuación estacional en el patrón de actividades..,(Fig. .4).
En la época de abundancia de frutos, fue mayor el consumo de éstos. En cambio, en la época de escasez tuvieron que incrementar el consumo de insectos y exudado para complementar su dieta. Como consecuencia de esto, el desplazamiento se incrementó notablemente, ya que recorrían casi la totalidad de su territorio en busca de nuevas fuentes alimenticias. El descanso, despioje y juego fue observado con mayor frecuencia en la época de abundancia, ya que como los recursos estaban más concentrados, no tenían que recorrer grandes distancias para encontrarlos y dedicaron más tiempo a otras actividades.
Vocalizaciones
Se pudo distinguir ocho tipos de vocalizaciones. Fleyman (com. pers.) logró diferenciar 12 vocalizaciones diferentes y los lugareños afirman haber escuchado 14. Parece ser que cada vocalización es típica para una situación determinada. Así, el chillido característico que emiten ante la presencia de un ave de rapiña es muy diferente a la vocalización producida cuando están alimentándose o cuando se enfrentan con un grupo rival.
Se pudo apreciar que las hembras adultas vocalizan con mayor frecuencia que los machos, sobre todo en la época de celo y receptividad sexual. Esta afirmación coincide con lo reportado por Shadle et al. (1965).
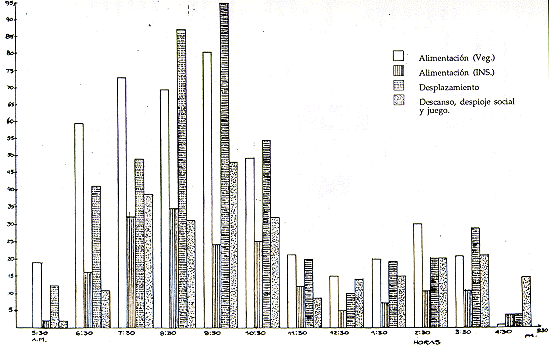
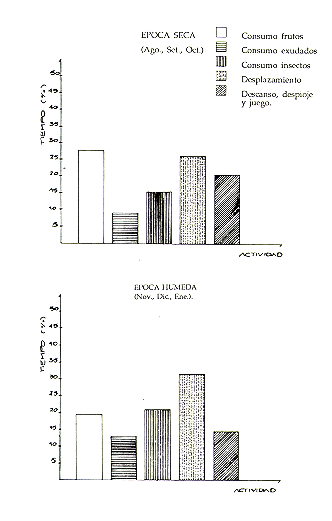
El repertorio vocal podría definirse como una serie de trinos, chillidos, silbidos y hasta gorjeos. La vocalización más comúnmente escuchada fue la de contacto, sobre todo en horas de la mañana en que la actividad era mayor. Esto también fue observado por Pook (1977).
Las vocalizaciones registradas fueron:
1. De contacto o llamado
2. De alarma
3. Canto (cuando descansaban)
4. Gorjeo (alimentación de frutos y exudados)
5. Trino (descanso y despioje)
6. De alimentación (insectos y otra presas)
7. Enfrentamiento
8. De las crías (solicitando alimento)
Comportamiento parental
El cuidado inicial de las crías corresponde a la madre, la que carga y amamanta durante los primeros días. Luego, el supuesto padre, ayudado por otros miembros del grupo (subadultos principalmente), se encarga de su cuidado, entregando las crías a la madre sólo para ser alimentadas.
El cuidado también consistía en despioje, caricias y en juego con ellas ocasionalmente. Según Terborgh y Goldizen (1981), en S. fuscicollis la mayoría de los miembros del grupo participa en el cuidado de las pero es notorio que la mayor parte del tiempo el macho adulto y presunto padre es el encargado de cuidar a las crías.
Cuando las crías eran pequeñas, todos compartían su alimento con ellas, pero después los miembros de la manada se volvían intolerantes con ellas y cada vez compartían menos, llegando incluso a intimidarlas y agredirlas. Este comportamiento "agresivo" hacia las crías, podría deberse a la escasez de alimentos o a que era el comportamiento normal hacia las crías de esa edad, para obligarlas a buscar sus propios alimentos. Al comienzo, las crías eran cargadas dorsalmente todo el tiempo, pero luego se volvían más independientes y cada vez pasaban más tiempo caminando a propio pie, pero cerca siempre al supuesto padre, y a la más mínima señal de peligro corrían y trepaban sobre su dorso. Generalmente recurrían al mismo individuo en busca de protección, pero si el peligro era inminente, se refugiaban en el individuo más cercano. Se pudo observar que las crías mayores eran rechazadas cuando intentaban subir al dorso de los adultos, incluso por el supuesto padre encargado de su cuidado.
Despioje social y juego
El despioje observado en los grupos estudiados, tenía dos variantes. una, el autodespioje era realizado por el mismo individuo en forma solitaria y valiéndose de su boca y manos; y el despioje social propiamente dicho, realizado por dos o más miembros del, grupo. Esta actividad fue observada con mayor frecuencia en horas de la mañana, sobre todo en los períodos de descanso colectivo y en las horas de fuerte calor. El despioje era casi siempre recíproco, es decir que el individuo que iniciaba la actividad generalmente terminaba siendo a su vez despiojado.
Casi siempre el despioje se realizaba entre individuos de sexos diferentes; esto coincide con las observaciones de Moynihan (1970). Se pudo apreciar que los machos adultos eran los que despiojaban con mayor frecuencia a las hembras. Estas también lo hacían, pero en menor proporción. También se observó que los machos adultos encargados del cuidado de las crías en las diferentes manadas, las despiojaban más frecuentemente que el resto de los miembros de la manada. Para realizar el despioje, usaban tanto la boca como las manos y adoptaban diversas posturas, siendo las más frecuentes la de echados y sentados sobre las ramas. Espulgaban todas las regiones del cuerpo, pero sobre todo el dorso, la cabeza y el abdomen. Soini (este volumen) observó que el despioje era realizado en los momentos de descanso colectivo y que eran secuencias, a menudo recíprocas, de despioje de un individuo por otro.
En cuanto al juego, éste fue observado principalmente entre crías y juveniles y, ocasionalmente entre éstos y los adultos. Consistía en saltos, carreras y persecuciones, a veces jugaban con ramas y hojas. En varias ocasiones se vio a dos crías jugando entre sí; en otras, a dos juveniles, a una hembra adulta con un juvenil y a un subadulto con una cría.
Comportamiento antagonístico
La agresión intragrupal fue mínima y podría afirmarse que se circunscribió casi exclusivamente a peleas y disputas por alimentos, tanto frutos como insectos. Se observó con mayor frecuencia entre crías y juveniles contra adultos y subadultos'. Pero en ocasiones se vio a dos adultos disputándose algún fruto o insecto. Se producían suplantaciones de un individuo por otro, como las observadas por Izawa (1978) y peleas generalmente breves, que terminaban con la huida de uno de ellos.
Se registró varios enfrentamientos entre manadas vecinas en defensa territorial. Se observó que en el límite entre las áreas domiciliarias de dos manadas continuas ha una zona de superposición que es usada por ambas manadas. Cuando las manadas coinciden en ella, se producen enfrentamientos que terminan con la huida de una de las manadas. Yoneda (1981) también observó enfrentamientos de defensa del territorio en manadas de S. fuscicollis y S. labiatus.
Soini (este volumen) afirma que S. fuscicollis defiende su territorio contra otras manadas de la misma especie y que las áreas domiciliarias de manadas vecinas a menudo se superponen parcialmente. Dawson (1977) también observó encuentros agresivos entre grupos de la misma especie (S. oedipus) en defensa de sus territorios.
En la época de escasez de frutos, la manada celeste invadió una parte del territorio de la manada roja, observándose en varias ocasiones enfrentamientos que incluían vocalizaciones, carreras, persecuciones y desplantes intimidatorios, que terminaban siempre con la huida de la manada roja. Hubo enfrentamientos sólo vocales entre otras manadas que habitaban distintas restingas, separadas por lagunas, las que en determinada época del año se secaban, permitiendo el paso de un lado al otro.
Relaciones interespecíficas
Se observó relaciones de competencia por frutos e insectos entre S. mystax y ciertas especies de aves, como por ejemplo paucares, pihuichos y locreros.
Hubo reacciones de alarma ante la presencia de posibles predatores, como aves de presa (Accipítridos y Catártidos). Los monos corrían a refugiarse en la parte más densa del follaje y permanecían silenciosos cuando sobrevolaba cerca alguna de estas aves. También se mostraron muy alarmados e inquietos cuando encontraban alguna serpiente. La literatura revisada indica que tanto el hombre como las aves de presa, mustélidos arbóreos, pequeños felinos y serpientes son sus principales enemigos. En otras áreas naturales, Aquino (1978), Castro y Soini (1977), Soini (este volumen) y Ramírez (1984) reportan que S. mystax vive en simpatría con S. fuscicollis, formando asociaciones más o menos estables y cohesivas. En Padre Isla, S. mystax era el único primate presente.
CONCLUSIONES
S. mystax es una especie frugívora e insectívora. También consume exudados y, ocasionalmente, brotes, hojas, flores, arañas y pequeños vertebrados. El 65% de la alimentación es de origen vegetal y el 35% de origen animal.
En la época de escasez de frutos aumenta el consumo de insectos y exudados. Existe un proceso de adaptación a nuevas fuentes alimenticias, que se vuelve más evidente en el período crítico.
El tamaño promedio de los grupos estudiados fue de 6 individuos de locomoción independiente. Había un mayor número de machos que de hembras. Durante el período de estudio se produjeron 4 migraciones y nacieron dos pares de mellizos.
Los grupos ocupaban territorios de 17,6 ha en promedio (13, 18 y 22 ha), defendidos activamente de la invasión de manadas vecinas.
Dedicaron el 34,5% de su tiempo al consumo de frutos y exudado, el 13,5% a la búsqueda y captura de insectos adultos, 32,0% al desplazamiento y 19,0% al descanso, despioje y juego.
El cuidado inicial de las crías correspondió a la madre; luego al supuesto padre, ayudado por los otros miembros de la manada.
El despioje social fue observado durante los descansos colectivos. Participaban dos o más individuos y las hembras eran despiojadas con mayor frecuencia que los machos.
Las agresiones intragrupales registradas fueron disputadas por frutos e insectos. Se observó enfrentamientos entre manadas vecinas en defensa territorial.
Hubo competencia entre S. mystax y ciertas aves (paucares, pihuichos y locreros) por frutos e insectos. También, se apreció reacciones de alarma ante la presencia de posibles predatores como aves de rapiña (Accipítridos y Catártidos) y serpientes.
REFERENCIAS
Aquino, R. (este volumen). La fauna primatológica en áreas de Jenaro Herrera.
Castro, R. y P. Soini. 1977. Field studies on Saguinus Mystax and other Callitrichids in Amazonian Peru. p. 73-78. En D. G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press., Wash., D. C.
Dawson, C. A. 1977. Composition and stability of social groups of the tamarin, Saguinus oedipus geoffroyi, in Panama. pp. 23-27. En D. G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Inst. Press, Wash., D. C.
Encarnación, F., R. Aquino y J. Moro. (este volumen). Flora y vegetación de la Isla Iquitos y Padre Isla (Loreto, Perú): su relación con el manejo semiextensivo de Saguinus mystax, Sairniri sciureus y Aotus.
Hershkovitz, P. 1977. Living New World Monkeys (Platyrrhini). The University of Chicago Press, Chicago. XIV + 1117 pp. y Figs.
Izawa, K. 1978. A field study of the ecology and behavior of the black-mantled tamarin, (Saguinus nigricollis). Primates 19(2). 241-274.
Jolly, A. 1972. The evolution of primate behavior. The MacMillan Company. N.Y., USA.
Malleux, J. 1975. Mapa Forestal del Perú. (Memoria Explicativa). Univ. Nac. Agraria La Molina, Lima. 161 pp.
Moya, L., L. Verdi, G. Bocanegra y J. Rimachi. (este volumen). Análisis poblacional de Saguinus mystax (Spix 1823) (Callitrichidae), en la cuenca del Río Yarapa, Loreto, Perú.
Moynihan, M. 1970. Some behavior patterns of Platyrrhine monkeys: II Saguinus geoffroyi and some other tamarins. Smithson. Contrib. Zool. 28: 1-77.
Napier, J. y P. Napier. 1967. A handbook of living primates. Academic Press, London-New York. 456 pp.
Neyman, P.F. 1977. Aspects of the ecology and social organization of free-ranging cottomop tamarins (Saguinus oedipus) and the conservation status of the species. p. 39-71. En D. G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae Smithsonian Institution Press, Wash, D.C.
Oficina Nacional de Evaluación de Recursos Naturales. ONERN. 1976. Mapa Ecológico del Perú y Guía Explicativa. Lima. 146 pp.
Pook, A.G. 1977. A comparative study of the use of contact calls in Saguinus fuscicollis and Callithrix jacchus. p. 271-280. En D. G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Wash., D.C.
Ramirez, M. 1984. Population recovery in the moustached tamarin (Saguinus mystax): Management strategies and mechanism of recovery. Amer. 1. Primatol. 7: 245259.
Shadle, A., E. Mirand y J. Grace. 1965. Breeding responses in tamarins. Lab. Anim. Care 15: 1-10.
Soini P. (este volumen). Ecología y dinámica poblacional del pichico Saguinus fuscicallis (Callithrichidae, Primates).
Soini, P. y M. Soini. (este volumen). Distribución geográfica y ecología poblacional de Saguinus mystax (Callitrichidae, Primates).
Terborgh, J. y A. W. Goldizen. 1981. Comportamiento y ecología de pichicos (Saguinus fuscicollis y Saguinus imperator). (Mimeografiado).
Yoneda, M. 1981. Ecological studies of Saguinus
fuscicollis and Saguinus labiatus with reference to habitat segregation
and height preference. Kyoto Univ. Overseas h Reports of New World Monkeys
2: 43-50.
